
分析 (1)氧化还原反应中 氧化剂的氧化性大于氧化产物,根据化合价判断反应中氧化剂和氧化产物,然后判断;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,据此书写离子反应方程式;
(3)在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性,据此回答.
解答 解:(1)①FeCl3溶液中滴入KI溶液,加CCl4振荡,CCl4层呈紫色,发生了反应FeCl3+2KI=2FeCl2+I2+2KCl,氧化剂Fe3+的氧化性大于I2;
②FeCl2溶液中滴加氯水,再加KSCN溶液,呈红色,说明氯气氧化亚铁离子生成铁离子和氯离子,反应为2Fe2++Cl2=2Fe3++2Cl-;反应中氧化剂Cl2氧化性大于氧化产物Fe3+;
③KMnO4溶液中滴加盐酸.KMnO4溶液的紫色褪去,说明高锰酸钾氧化氯离子为氯气,本身被还原为锰离子;反应中氧化剂KMnO4的氧化性大于氧化产物Cl2;
综上所述氧化性强弱为MnO-4>Cl2>Fe3+>I2;
故选B;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,反应中Cr的价态升高了3价,pb的化合价降低2价,根据电子守恒,所以与1mol Cr3+反应所需PbO2的物质的量为1.5mol,所发生的离子反应方程式为3PbO2+2 Cr3++H2O═Cr2O72-+3Pb2++2H+,故答案为:3PbO2+2Cr3++H2O═Cr2O72-+3Pb2++2H+;
(3)①Cu与FeCl3溶液能反应:2FeCl3+Cu═2FeCl2+CuCl2,氧化剂氧化性大于氧化产物的氧化性,则可证明氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强,
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
③Fe能与CuSO4溶液反应置换出Cu,符合活泼金属置换出不活泼金属的原则,Fe+CuSO4═FeSO4+Cu,可证明铁的还原性比铜强,
故答案为:Fe+CuSO4═FeSO4+Cu.
点评 本题考查氧化还原反应中的规律、离子方程式的书写,明确物质性质及离子方程式书写规则即可解答,注意不能漏掉反应的离子,要注意电荷守恒、转移电子守恒及原子守恒.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤是根据物质颗粒大小的差别来分离或提纯物质的一种方法 | |
| B. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| C. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 | |
| D. | 不慎将油汤洒在衣服上可用酒精、汽油除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
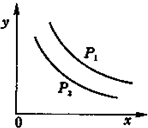 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )| A. | a>b | B. | 上述反应是吸热反应 | ||
| C. | 升温K减小 | D. | 加压K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发浓缩 | B. | 加CuCl2固体 | C. | 加入AgNO3 | D. | 加入食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子浓度变小 | B. | 醋酸的浓度减小 | ||
| C. | 酸性增强,PH变小 | D. | 醋酸根离子浓度变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag++Cl-═AgCl↓,AgNO3+NaCl═AgCl↓+NaNO3 | |
| B. | Cu+2Ag+═Cu2++2Ag,Cu+2AgCl═CuCl2+2Ag | |
| C. | Ba2++SO${\;}_{4}^{2-}$═BaSO4↓,Ba(OH)2+H2SO4═BaSO4+2H2O | |
| D. | CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O,NaHCO+HCl═NaCl+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1.8g18O2中含有NA个质子 | |
| B. | 28gC2H4中含有4NA个C-H键 | |
| C. | 常温下,2.7g铝片投入足量的稀硫酸中,铝失去的电子数为0.3NA | |
| D. | 4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com