
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 , 向其中加入少量KOH溶液时,发生反应的离子方程式是;
(2)现将0.04molL﹣1HA溶液和0.02molL﹣1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)c(CN﹣)(填“<”、“=”或“>”),你得出该结论的依据是;该混合溶液的质子守恒式是 .
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是 . 该混合溶液的物料守恒式是 .
【答案】
(1)A﹣+H+?HA;HA+OH﹣?H2O+A﹣
(2)>;因为c(Na+)+c(H+)=C(CN﹣)+c(OH﹣),溶液显碱性,则c(H+)<c(OH﹣),所以c(Na+)>c(CN﹣);c(OH﹣)=c(H+)+ ![]() c(HCN)﹣
c(HCN)﹣ ![]() c(CN﹣);c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣);2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
c(CN﹣);c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣);2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
【解析】解:(1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时发生:A﹣+H+HA,加入碱时发生:HA+OH﹣H2O+A﹣ , 溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用,所以答案是:A﹣+H+HA;HA+OH﹣H2O+A﹣;(2)①该溶液显碱性,则c(H+)<c(OH﹣),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN﹣)+c(OH﹣),溶液中物料守恒为2c(Na+)=c(CN﹣)+c(HCN),则c(Na+)>c(CN﹣),则质子守恒为c(OH﹣)=c(H+)+ ![]() c(HCN)﹣
c(HCN)﹣ ![]() c(CN﹣);
c(CN﹣);
所以答案是:>;因为c(Na+)+c(H+)=C(CN﹣)+c(OH﹣),溶液显碱性,则c(H+)<c(OH﹣),所以c(Na+)>c(CN﹣);c(OH﹣)=c(H+)+ ![]() c(HCN)﹣
c(HCN)﹣ ![]() c(CN﹣);②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH﹣),根据溶液电中性原则可知c(CH3COO﹣)>c(Na+),溶液中溶质为等浓度的醋酸和醋酸钠,则物料守恒为2c(Na+)=c(CH3COO﹣)+c(CH3COOH),
c(CN﹣);②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH﹣),根据溶液电中性原则可知c(CH3COO﹣)>c(Na+),溶液中溶质为等浓度的醋酸和醋酸钠,则物料守恒为2c(Na+)=c(CH3COO﹣)+c(CH3COOH),
所以答案是:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣).


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是 .
(2)固体成分的初步确定.
实验序号 | 操作及现象 |
ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
①由上述实验可知:溶液中Fe元素的存在形式有
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)
③生成O2的化学方程式是
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4 .
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
实验序号 | 操作、现象 |
ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; |
ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2 , |
提示:KSCN中S元素的化合价为﹣2价
①实验ⅲ中白色沉淀的化学式是
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是
③查阅资料得知:Cl﹣对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A.在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA
B.在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA
C.在标准状况下,64g SO2 中含有的原子数为3NA
D.在标准状况下,11.2L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为(用元素符号表示).
②M是含有键的分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为 , W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: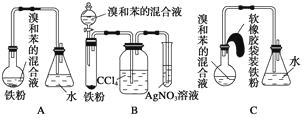
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题
(1)电解池就是把能转化能的装置
(2)常温下KW数值= .
(3)常温下,某溶液中的c(H+)=5.0×10﹣7 molL﹣1 , 则此时c(OH﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com