
分析 氯气和溴化钠反应方程式为2NaBr+Cl2=2NaCl+Br2,溴在加热过程中易挥发,所以充入足量氯气后得到的固体是氯化钠,则固体减少的质量为溴和氯气的质量差,利用差量法计算溴化钠的质量,再根据总质量计算出混合物氯化钠的质量,最后根据n=$\frac{m}{M}$计算出二者的物质的量之比.
解答 解:设混合物中溴化钠的质量为x,
2NaBr+Cl2=2NaCl+Br2 固体减小的质量
206 89
x (5.29-3.51)g=1.78g
则:206:89=x:1.78g,
解得:x=4.12g,
则混合物中氯化钠的质量为:5.29g-4.12g=1.17g,
原混合物中NaC1和NaBr的物质的量之比为:$\frac{1.17g}{58.5g/mol}$:$\frac{4.12g}{206g/mol}$=1:1
答:原混合物中NaC1和NaBr的物质的量之比为1:1.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用方法,试题侧重基础知识的考查,有利于培养学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
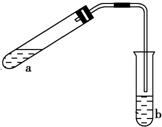 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
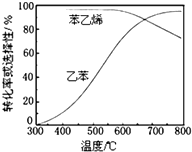 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: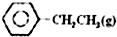 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$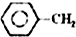 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
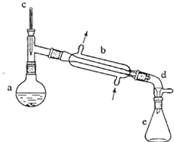 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: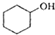 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$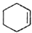 +H2O
+H2O| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com