
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
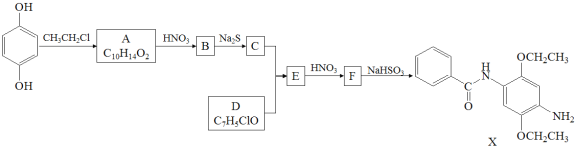
已知: ;
;![]()
请回答:
(1)下列说法正确的是____________。
A.化合物A能与FeCl3溶液发生显色反应 B.化合物C具有弱碱性
C.化合物F能发生加成、取代、还原反应 D.X的分子式是C17H22N2O3
(2)化合物B的结构简式是___________________________________________________。
(3)写出C+D→E的化学方程式_____________________________________________________。
(4)写出化合物A(C10H14O2)同时符合下列条件的同分异构体的结构简式_____________________________。
1H-NMR谱和IR谱检测表明:①分子中有4种化学环境不同的氢原子;②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。
(5)设计以CH2=CH2和![]() 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)
)的合成路线(用流程图表示,无机试剂任选)
_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为__________________________________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___________________molL1min1。
②25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
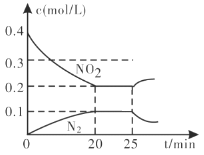
A.缩小容器体积 B.增加NO2的浓度 C.降低温度 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬矿是冶金、国防、化工等领域不可缺少的矿产资源,其中的铬铁矿是唯一可开采的铬矿石。工业上常用铬铁矿(主要含Fe2O3、FeO和Cr2O3,还含有MgO、Al2O3、SiO2等杂质)为原料制备重铬酸钾和三氧化二铁,其流程如图所示。

已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。

请回答下列问题:
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是___________.
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:___。由于在该过程中铁元素会大量转变为NaFeO2,所以加水的作用为__________________(用离子方程式表示)。
(3)“滤渣 2”的主要成分为_________(填化学式)。
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取___________(填操作名称)。
(5)调节pH3的范围为__________
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为______t(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2P4+9KOH+3H2O═3K3PO4+5PH3反应中氧化剂是______; 氧化剂与还原剂物质的量之比是_________;氧化产物是____________。
(2)请用双线桥法标出下列反应电子转移的方向和数目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O______________________
(3)Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O组成的一个氧化还原系统中,发生BiO3﹣→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是____________。
②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
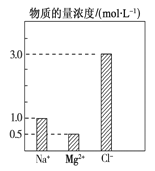
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com