
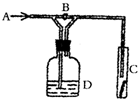
| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | NaBr溶液 |
分析 干燥氯气不能使有色布条褪色,当关闭B时,气体经过D装置,C处红色布条颜色褪去,说明氯气通过D装置后,含有水蒸气.
解答 解:A.氯气经过盛有浓硫酸的洗气瓶,为干燥氯气,不能使有色布条褪色,故A错误;
B.氯气难溶于饱和食盐水,经过饱和食盐水后,氯气中混有水,能生成具有漂白性的HClO,可使有色布条褪色,故B正确;
C.氯气经过盛有NaOH溶液的洗气瓶而被吸收,则有色布条不褪色,故C错误;
D、氯气经过NaBr溶液后,氯气和溴化钠反应,Cl2+NaBr=Br2+2NaCl,可吸收氯气,不能使有色布条褪色,故D错误;
故选B.
点评 本题考查氯气的性质,题目难度不大,本题注意氯气使有色布条褪色的原因是能生成具有漂白性的HClO.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
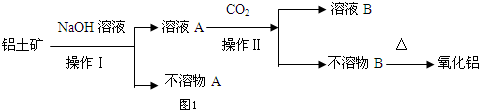
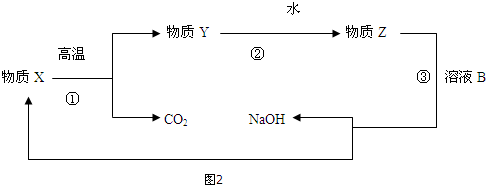
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
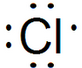 .
.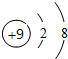 .
. D2-的电子式为
D2-的电子式为 .
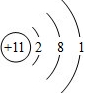
. ;Z元素原子的电子式为
;Z元素原子的电子式为 .
.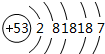 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
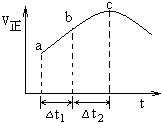 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 该反应为放热反应 | |
| B. | 反应物浓度:c>b>a | |
| C. | a、b均未建立平衡,c点恰好达到平衡 | |
| D. | 若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
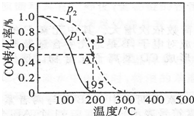
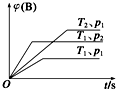 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H<0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | NaCl的电子式: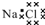 | ||
| C. | Cl-的结构示意图: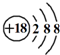 | D. | CH4的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体中一定含Fe | B. | 剩余固体中一定含Fe和Cu | ||
| C. | 剩余固体中一定不含Cu | D. | 剩余固体中一定含Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com