
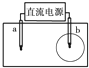
 如图所示,取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
如图所示,取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
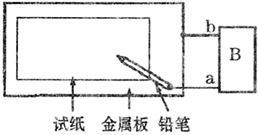 取一张用饱和的NaCl溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图所示的方法连接电路.
取一张用饱和的NaCl溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图所示的方法连接电路.查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示:
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2012届福建省漳州市芗城中学高三适应性检测化学试卷(带解析) 题型:填空题
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示: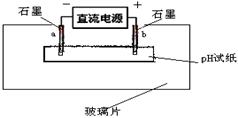
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省漳州市高三适应性检测化学试卷(解析版) 题型:填空题
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示:

取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com