
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__,装置B中玻璃棒的作用是__,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__,①中加入沸石的作用是__,冷却水的方向是__。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置__。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__,不产生白色沉淀表明Cl已除净。
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不能正确表达反应颜色变化的是( )
A.向氯水中通入SO2气体,溶液浅黄绿色消失:Cl2 + SO2 + 2 H2O = 4H+ + 2Cl- + SO42-
B.向AgNO3溶液中加入一定量HCl溶液,后加入Na2S溶液,白色沉淀变黑色:2AgCl + S2- = Ag2S + 2Cl-
C.向氢氧化铁胶体中加入HI酸溶液,首先出现红褐色沉淀,后沉淀消失,溶液变为黄色:2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O
D.向CrO42-中加入H2SO4溶液,颜色由黄色变为橙色:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液500mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是______________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________________________。
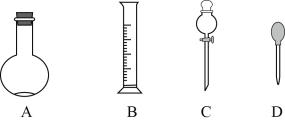
(2)在容量瓶的使用方法中,下列操作不正确的是______________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加入至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1mol/L(填“大于”、“小于”或“等于”)。
(4)根据计算得知,需用量筒取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol Na2O2固体中含有离子4NA
B. 标准状况下,11.2 L CH3CH2OH中含有分子0.5 NA
C. 常温常压下,3.2 g CH4中含有电子2 NA
D. 0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
![]() 基态
基态![]() 的价层电子排布图
的价层电子排布图![]() 轨道表达式
轨道表达式![]() 为________,C、N、O的第一电离能从小到大的顺序为________
为________,C、N、O的第一电离能从小到大的顺序为________
![]() 、P可形成一些复杂离子,如
、P可形成一些复杂离子,如![]() 、
、![]() 、
、![]() 等。
等。
![]() 中N原子的杂化类型为________,
中N原子的杂化类型为________,![]() 的空间构型是为________
的空间构型是为________
![]() 是一种白色固体,在加压下于
是一种白色固体,在加压下于![]() 时液化,形成一种能导电的熔体。熔体能导电的原因是________
时液化,形成一种能导电的熔体。熔体能导电的原因是________
![]() 、Ni易与
、Ni易与![]() 与
与![]() 互为等电子体
互为等电子体![]() 形成配合物,
形成配合物,![]() 中
中![]() 键与
键与![]() 键个数比为________,
键个数比为________,![]() 熔点
熔点![]() ,沸点
,沸点![]() ,不溶于水,溶于乙醇、苯等有机溶剂,
,不溶于水,溶于乙醇、苯等有机溶剂,![]() 属于________晶体
属于________晶体
![]() 、NiO的晶体类型与结构和NaCl相同。
、NiO的晶体类型与结构和NaCl相同。
![]() 熔点FeO________
熔点FeO________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
![]() 晶胞如下图,
晶胞如下图,![]() 的配位数为________
的配位数为________

![]() 在氧气中加热,部分
在氧气中加热,部分![]() 被氧化为
被氧化为![]() ,晶体结构产生铁离子缺位的缺陷,其组成变为
,晶体结构产生铁离子缺位的缺陷,其组成变为![]() ,测得晶胞边长为acm,密度为
,测得晶胞边长为acm,密度为![]() ,则
,则![]() ________
________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是_______(结合化学用语回答)。
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①② 。

实验①中产生蓝色沉淀的离子方程式为_________,根据以上反应现象写出甲组同学实验中的离了方程式_________,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_________。
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,

K闭合时,指针发生偏转,盐桥中的阳离子向______极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动。据此分析I-还原性强弱与浓度关系______________。
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入______(填“酸式”或“碱式”)滴定管,选用淀粉济液为指示剂,滴定终点现象为_______________。
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
![]() 基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态
基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态![]() 和非晶态
和非晶态![]() 最可靠的科学方法是对固体进行________。
最可靠的科学方法是对固体进行________。
![]() 钙钛矿
钙钛矿![]() 可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物
可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物![]() ,其中氧原子的杂化方式为________,
,其中氧原子的杂化方式为________,![]() 的空间构型为________。
的空间构型为________。
![]() 在浓的
在浓的![]() 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为![]() 的绿色晶体,该晶体中两种配体的物质的量之比为
的绿色晶体,该晶体中两种配体的物质的量之比为![]() ,则该配离子的化学式为________。
,则该配离子的化学式为________。
![]() 钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
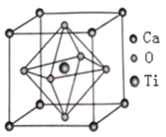
![]() 钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________
钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素是一种天然染料,工业上可用石油的裂解产物通过如图反应制得:
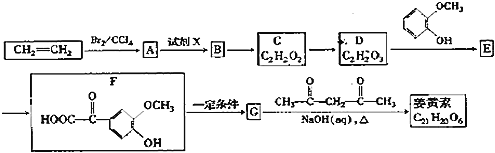
已知:![]()
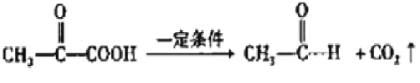
![]() CH3CHO+
CH3CHO+![]()
![]()
![]() +H2O
+H2O
请回答下列问题:
![]() 试剂X为 ______ ;
试剂X为 ______ ;
![]() 最多能消耗Na、NaOH、
最多能消耗Na、NaOH、![]() 的物质的量分别为3mo1、2mol、1mol,则E的结构简式为 ______ ;
的物质的量分别为3mo1、2mol、1mol,则E的结构简式为 ______ ;
![]() 姜黄素中的含氧官能团除甲氧基
姜黄素中的含氧官能团除甲氧基![]() 外还有 ______
外还有 ______ ![]() 写名称
写名称![]() ;
;
![]() 反应
反应![]() 的化学方程式为 ______ ,其反应类型是 ______ ;
的化学方程式为 ______ ,其反应类型是 ______ ;
![]() 符合下列条件G的同分异构体共有 ______ 种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是 ______ ;
符合下列条件G的同分异构体共有 ______ 种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是 ______ ;
①属于芳香酯类 ②苯环上有两个取代基 ③能与![]() 溶液发生显色反应
溶液发生显色反应
![]() 借鉴制取姜黄素的方法也能合成肉桂醛(
借鉴制取姜黄素的方法也能合成肉桂醛(![]() ),写出制备肉桂醛所需有机物的结构简式 ______ 。
),写出制备肉桂醛所需有机物的结构简式 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com