
【题目】能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
科目:高中化学 来源: 题型:
【题目】Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式___。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是___。
向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐___(填“变大”、“变小”),生成的沉淀是___;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___。
a.c(Na+)=c(S2O32-) +2c(HSO3-)+2c(H2SO3) + 2c(HS-)
b.c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-) +c(HS-) +c(OH-)
c.c(Na+)=2c(HS-)
d.c(Na+)=2c(HS-)+2c(S2O32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的密闭容器中,充入浓度分别为0.20mol·L-1、0.10mol·L-1 SO2和O2,发生反应:2SO2(g)+O2(g)2SO3(g)。当反应达到平衡时,不可能存在的数据是
A.SO2为0.10 mol·L-1B.O2为0.05mol·L-1
C.SO2为0 mol·L-1D.SO3为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。
回答下列问题:

(1)装置A中盛放稀盐酸的仪器名称为__________________。
(2)装置B的作用是______________________________________。
(3)装置C的作用是____________________________________________。
(4)装置D中发生反应的化学方程式是_____________、_______________。
(5)装置E中碱石灰的作用是______________________________________。
(6)若开始时称得样品的质量为4.52 g,反应结束后称得固体的质量为6.36g,则Na2O2试样的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100 mL气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为
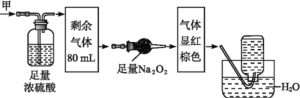
A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、COD.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法错误的是( )
A. 4.6g由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA
B. 0.2gD216O中含有的质子数,中子数,电子数均为0.1NA
C. 6.2克白磷分子(P4)中含P—P键为0.05NA
D. 铁与足量稀硝酸反应时,生产0.1molNO转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶A和盛有潮湿有色布条的广口瓶B,可观察到的现象是__,发生该现象的原因___。(试用离子方程式和简单文字解释)
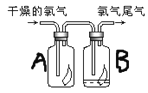
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用__溶液吸收多余的氯气,原理是___(用化学方程式表示)。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__(填化学式),长期露置于空气中的漂白粉会变质,变质后的漂白粉加稀盐酸后产生的气体是__(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】理论上不能设计为原电池的化学反应是,注:△H<0为放热反应
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l);△H<0
CO2(g)+2H2O(l);△H<0
B.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(aq);△H<0
C.2H2(g)+O2(g)![]() 2H2O(g);△H<0
2H2O(g);△H<0
D.2FeCl3(l)+Fe(s)==3FeCl2(l);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
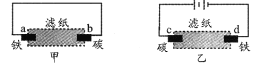
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com