
| A. | NH3+H2O+CO2=NH4HCO3 | |
| B. | 2NH3+CO2$\frac{\underline{\;180-200℃\;}}{15-30MPa}$ CO(NH2)2+H2O | |
| C. | 8NH3+3Cl2═N2+6NH4Cl | |
| D. | 2NH3+2O2$\frac{\underline{\;一定条件\;}}{\;}$NH4NO3+H2O |
分析 原子利用率是期望产物的总质量与生成物的总质量之比,根据绿色化学的原则,原子利用率为100%的化工生产最理想,原子利用率最高.
解答 解:根据绿色化学的原则,原子利用率为100%的化工生产最理想,原子利用率最高.
A.该反应中反应物全部转化为生成物,原子利用率为100%;
B.水为副产品,原子利用率=$\frac{60}{60+18}$×100%=76.9%;
C.N2为副产品,原子利用率=$\frac{53.5×6}{53.5×6+28}$×100%=91.98%;
D.水为副产品,原子利用率=$\frac{80}{80+18}$×100%=81.63%.
所以原子利用率最高的是A.
故选:A.
点评 本题考查了化学方程式,涉及原子利用率的比较,题目难度不大,注意把握绿色化学的概念和意义.


科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 300mL | C. | 490mL | D. | 720mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
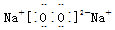 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的体积百分含量保持不变 | |
| B. | SO2速率是O2速率的2倍 | |
| C. | SO3的浓度是O2浓度的2倍 | |
| D. | 单位时间内SO2消耗的浓度等于SO3生成的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | c | |
| b |
| A. | a的气态氢化物的水溶液呈酸性 | B. | c的气态氢化物的稳定性最强 | ||
| C. | b的氧化物的水化物是强酸 | D. | 三种元素的原子半径c最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃可反应生成硝基苯 | |
| B. | 乙苯可被酸性高锰酸钾溶液氧化为苯甲酸 | |
| C. | 甲苯与氯气在光照下发生一元取代反应,主要生成2-氯甲苯或4-氯甲苯 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com