
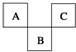
 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是B<A<C | |
| B. | A元素最高价氧化物对应水化物具有强氧化性和不稳定性 | |
| C. | B元素的氧化物和氢化物的水溶液都呈酸性 | |
| D. | C元素的单质是非金属单质中唯一能跟水激烈反应的单质 |
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,设B原子序数是x,则A的原子序数是x-9、C原子序数是x-7,A、B、C三种元素原子核外电子数之和等于B原子的质量数,B原子核内质子数和中子数相等,则x-9+x+x-7=2x,解得x=16,故A为N元素、B为S元素、C为F元素,据此解答.
解答 解:A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,设B原子序数是x,则A的原子序数是x-9、C原子序数是x-7,A、B、C三种元素原子核外电子数之和等于B原子的质量数,B原子核内质子数和中子数相等,则x-9+x+x-7=2x,解得x=16,故A为N元素、B为S元素、C为F元素.
A.同周期自左而右原子半径减小、电子层越多原子半径越大,故原子半径:B>A>C,故A错误;
B.A元素的最高价氧化物的水化物是硝酸,硝酸具有强氧化性,硝酸不稳定,见光受热易分解,故B正确;
C.B元素氧化物的水化物有H2SO3、H2SO4,氢化物是H2S,这三种物质都是二元酸,其水溶液都呈酸性,故C正确;
D.C为F元素,非金属性最强,单质是非金属单质中唯一能跟水激烈反应的单质,故D正确,
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,难度不大,推断元素是解题关键,注意理解同主族元素原子序数关系.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
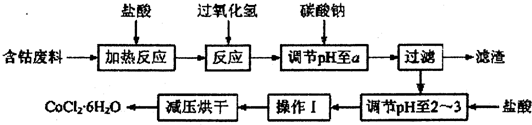
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧生成四氧化三铁 | B. | 常温下,铁在浓硫酸中会发生钝化 | ||
| C. | 铁与盐酸反应生成氯化铁与氢气 | D. | 铁是一种银白色金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| D. | 辛烷、己烯和苯在工业上都可直接通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、油脂、蛋白质均是天然高分子化合物 | |
| B. | 聚氯乙烯塑料制品可用于食品包装 | |
| C. | “地沟油”可以食用,也可以用来制肥皂 | |
| D. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com