
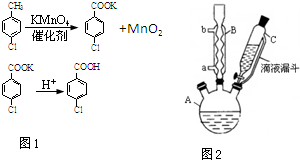
 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
分析 一定量的对氯甲苯和适量KMnO4在93℃反应一段时间后停止反应生成对氯苯甲酸钾和二氧化锰,二氧化锰不溶于水,加入稀硫酸酸化,生成对氯苯甲酸,对氯苯甲酸属于可溶性盐,加热浓缩、冷却结晶、过滤,洗涤滤渣得对氯苯甲酸.
(1)根据仪器的图形判断;
(2)量取6.OOmL对氯甲苯,结合量取体积精度可知应选择滴定管,且对氯甲苯容易腐蚀橡皮管;
(3)控制温度在93℃左右,低于水的沸点,可以采取水浴加热;对氯甲苯易挥发,对氯甲苯的加入方法是逐滴加入而不是一次性加入,以提高原料的利用率;
(4)二氧化锰不溶于水,过滤可除去;对氯苯甲酸钾与稀硫酸反应生成对氯苯甲酸,对氯苯甲酸微溶于水,是白色沉淀;
(5)除去对氯苯甲酸表面的可溶性杂质并尽量减小对氯苯甲酸的损耗;
(6)根据对氯甲苯质量计算对氯苯甲酸的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)由仪器的图形可知,B为球形冷凝管;
故答案为:球形冷凝管;
(2)量取6.OOmL对氯甲苯,结合量取体积精度可知应选择滴定管,对氯甲苯是一种优良的有机溶剂,对碱式滴定管上橡胶制品有明显的溶解腐蚀作用,则选25mL酸式滴定管,
故答案为:C;
(3)控制温度在93℃左右,低于水的沸点,可以采取水浴加热,对氯甲苯易挥发,对氯甲苯的加入方法是逐滴加入而不是一次性加入,以提高原料的利用率,
故答案为:水浴加热;减少对氯甲苯的挥发,提高原料利用率;
(4)对氯甲苯和适量KMnO4反应生成对氯苯甲酸钾和二氧化锰,二氧化锰不溶于水,步骤③过滤得到滤渣MnO2;滤液中加入稀硫酸酸化,对氯苯甲酸钾与稀硫酸反应生成对氯苯甲酸,对氯苯甲酸微溶于水,是白色沉淀,可观察到的实验现象是产生白色沉淀;
故答案为:除去MnO2;产生白色沉淀;
(5)对氯苯甲酸微溶于水,热水洗涤可能增大对氯苯甲酸的溶解度使其损耗,用冷水进行洗涤既可除去对氯苯甲酸表面的可溶性杂质还能减小对氯苯5酸的损耗;
故答案为:可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗;
(6)对氯甲苯的质量为:6ml×1.07g•cm-3=6.42g,由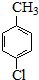 ~
~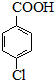 ,可知对氯苯甲酸的理论产量为 $\frac{6.42g}{126.5g/mol}$×156.5g,
,可知对氯苯甲酸的理论产量为 $\frac{6.42g}{126.5g/mol}$×156.5g,
则对氯苯甲酸的产率为:[7.19g÷($\frac{6.42g}{126.5g/mol}$×156.5g)]×100%≈90%,故选D.
点评 本题考查有机物的制备实验,为高考常见的题型,侧重于学生的分析能力和实验能力的考查,注意把握合成流程中的反应条件、已知信息等推断各物质,熟悉有机物的结构与性质即可解答,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 分离乙酸和乙酸乙酯,常用蒸馏法 | |
| B. | 提纯含有碘的氯化铵,常用升华法 | |
| C. | 除去碳酸钠中的少量碳酸氢钠,常用加热法 | |
| D. | 除去CO2中的SO2,通过盛有溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①⑤④ | B. | ①②③⑤④ | C. | ③①②④⑤ | D. | ①⑤②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
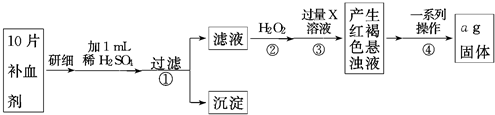
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫OH-+SO2=HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+=Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
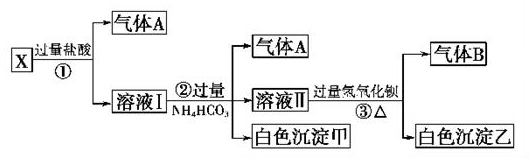
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
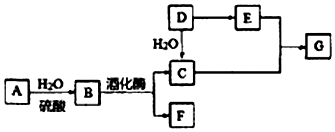
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com