
分析 发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,结合差量法及原子守恒计算.
解答 解:设混合物中碳酸氢钠的质量为x,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168 62
x 19g-15.9g
$\frac{168}{x}=\frac{62}{19g-15.9g}$,解得x=8.4g,
则碳酸钠的质量为19g-8.4g=10.6g,
n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,n(NaHCO3)=$\frac{8.4g}{84g/mol}$=0.1mol,
由C原子守恒可知生成n(CO2)=0.1mol+0.1mol=0.2mol,
气体体积为0.2mol×22.4L/mol=4.48L,
答:原混合物中碳酸钠的质量为10.6g,取等质量的混合物投入到过量的盐酸中,产生气体4.48升(标准状况).
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及差量法计算为解答的关键,侧重分析与计算能力的考查,注意差量法在计算中的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
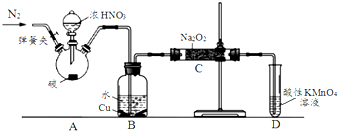
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒瓶盖,产生大量气泡 | |
| B. | 氢气与碘蒸气的平衡体系,加压后颜色加深 | |
| C. | 制取乙酸丁酯时,加入过量的乙酸 | |
| D. | 配制氯化铁溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
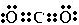 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com