
| A、11:1 | B、9:2 |
| C、12:11 | D、9:1 |
| 1×10-12 |
| 1×10-10 |
| 0.1mol/L×x-0.01mol/L×y |
| x+y |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
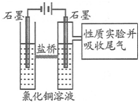 利用如图装置作电解50mL 0.5mol/L的CuCl2溶液实验.
利用如图装置作电解50mL 0.5mol/L的CuCl2溶液实验.查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | ||||
| B、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | ||||
C、H
| ||||
| D、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2HgO
| ||||
B、2NaCl(熔融)
| ||||
C、2MgO(熔融)
| ||||
D、Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2跟 H2O反应转移电子的数目为2NA |
| B、1 mol氯气跟NaOH反应转移电子的数目为NA |
| C、常温常压下,22.4 L氯气所含原子数为2NA |
| D、标准状况下,22.4 L蒸馏水所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C、反应产物的总能量大于反应物的总能量时,△H>0 |
| D、△H的大小与热化学方程式的计量系数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压有利于SO2与O2反应生成SO3 |
| B、用过量空气煅烧硫铁矿可以提高原料的利用率 |
| C、加入催化剂都能使合成氨的反应速率加快 |
| D、温度过高对合成氨反应不利 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com