


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:

| 用品(填序号) | 现象 | 结论 | 实验1 | ①③ | 溶液呈红色 | HCl没有漂白性 HCl没有漂白性 |
实验2 | ②⑤ ②⑤ |
试纸不褪色 试纸不褪色 |
Cl2没有漂白性 | 实验3 | ②④ ②④ |
试纸先变红后褪色 试纸先变红后褪色 |
Q具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体──氯气。某实验小组的同学运用这一原理设计如图所示的实验装置制取干燥的氯气,并通过实验研究氯气的性质。
(1)仪器a的名称是 ,B中盛放的试剂是 ,D中盛放的试剂是 。
(2)向集满氯气的矿泉水瓶C中加入少量水,振荡后瓶子变瘪,溶液变成浅黄色,由此可得出的结论是: 。
(3)取少量(2)中所得溶液滴入到紫色石蕊溶液中,溶液先变为红色后又褪色。甲同学认为氯气与水发生了化学反应,生成物中有盐酸,验证有Cl-所需要的试剂是 。
乙同学认为氯气与水发生化学反应还有一种产物Q、盐酸、Cl2和Q三种物质均可使石蕊溶液褪色,他选用下列实验用品进行实验探究,请将实验报告填写完整。
实验用品:①石蕊溶液②蓝石蕊试纸③盛有盐酸的试管④盛有氯水的试管⑤充有干燥氯气的试管
|
| 用品(填序号) | 现象 | 结论 |
| 实验1 | ①③ | 溶液呈红色 |
|
| 实验2 |
|
| Cl2没有漂白性 |
| 实验3 |
|
| Q具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京师大附中高一上学期期末考试化学试卷 题型:实验题
(15分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体──氯气。某实验小组的同学运用这一原理设计如图所示的实验装置制取干燥的氯气,并通过实验研究氯气的性质。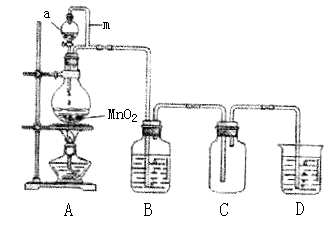
(1)仪器a的名称是 ,B中盛放的试剂是 ,D中盛放的试剂是 。
(2)向集满氯气的矿泉水瓶C中加入少量水,振荡后瓶子变瘪,溶液变成浅黄色,由此可得出的结论是: 。
(3)取少量(2)中所得溶液滴入到紫色石蕊溶液中,溶液先变为红色后又褪色。甲同学认为氯气与水发生了化学反应,生成物中有盐酸,验证有Cl-所需要的试剂是 。
乙同学认为氯气与水发生化学反应还有一种产物Q、盐酸、Cl2和Q三种物质均可使石蕊溶液褪色,他选用下列实验用品进行实验探究,请将实验报告填写完整。
实验用品:①石蕊溶液②蓝石蕊试纸③盛有盐酸的试管④盛有氯水的试管⑤充有干燥氯气的试管
| | 用品(填序号) | 现象 | 结论 |
| 实验1 | ①③ | 溶液呈红色 | |
| 实验2 | | | Cl2没有漂白性 |
| 实验3 | | | Q具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2014届北京师大附中高一上学期期末考试化学试卷 题型:实验题
(15分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体──氯气。某实验小组的同学运用这一原理设计如图所示的实验装置制取干燥的氯气,并通过实验研究氯气的性质。
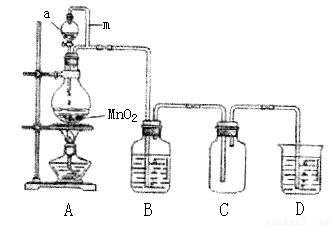
(1)仪器a的名称是 ,B中盛放的试剂是 ,D中盛放的试剂是 。
(2)向集满氯气的矿泉水瓶C中加入少量水,振荡后瓶子变瘪,溶液变成浅黄色,由此可得出的结论是: 。
(3)取少量(2)中所得溶液滴入到紫色石蕊溶液中,溶液先变为红色后又褪色。甲同学认为氯气与水发生了化学反应,生成物中有盐酸,验证有Cl-所需要的试剂是 。
乙同学认为氯气与水发生化学反应还有一种产物Q、盐酸、Cl2和Q三种物质均可使石蕊溶液褪色,他选用下列实验用品进行实验探究,请将实验报告填写完整。
实验用品:①石蕊溶液②蓝石蕊试纸③盛有盐酸的试管④盛有氯水的试管⑤充有干燥氯气的试管
|
|
用品(填序号) |
现象 |
结论 |
|
实验1 |
①③ |
溶液呈红色 |
|
|
实验2 |
|
|
Cl2没有漂白性 |
|
实验3 |
|
|
Q具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com