
【题目】下列各元素全部是微量元素的是
A.Na、K、PB.Ca、Mg、C
C.H、O、ND.Cu、Zn、Mn
科目:高中化学 来源: 题型:
【题目】在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)
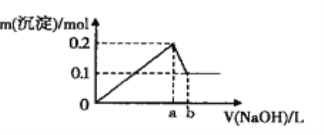
则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,Fe2+结合S2﹣的能力大于结合OH﹣的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 氧化物:CO2、NO、SO2、H2O B. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
C. 铵盐:NH4Cl、NH4NO3、NH3·H2O D. 碱性氧化物:Na2O、CaO、CO2、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度,在1L恒容密闭容器中,加入10molCO、7molH2S,发生如下反应:CO(g)+H2S(g)COS(g)+H2(g),达平衡时CO物质的量为8mol,下列说法正确的是( )
A.该温度下,化学平衡常数K=0.1
B.H2S的平衡转化率为20%
C.增大CO浓度,平衡正向移动,可以提高CO的转化率
D.升高温度,H2S浓度增加,表明该反应正方向是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物的废水有毒,特别是Cr(Ⅵ)有致癌作用,对农作物及微生物的毒害很大.目前处理的方法较多,还原沉淀法是较为广泛的处理含铬废水的方法,流程如图: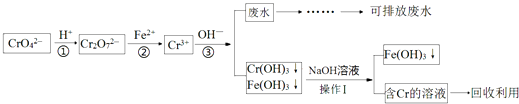
(1)步骤①中存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O该反应的平衡常数表达式K=;碱性溶液中Cr(Ⅵ)离子的颜色呈 . (填“黄色”或“橙色”)
(2)上述操作Ⅰ的名称为 , 以下物质可用于代替步骤②中的Fe2+的是
A.KMnO4(H+) B.HNO3 C.Na2SO3
(3)步骤③中出水总铬与溶液的pH关系如图,下列说法不正确的是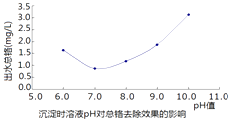
A.为有效除去Cr3+ , 加入的碱越多越好
B.Cr(OH)3可溶于强碱
C.要除去Cr3+ , 调节pH值最好为7左右
(4)已知Ksp[Cr(OH)3]=1.1×10﹣32 , 按《污水综合排放标准》,水质中总铬的浓度应小于3×10﹣5molL﹣1 , 当步骤③调节pH=6时,该处理后的污水是否达到排放标准?(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100g/mol,将5.0g CaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Ca2+ 的物质的量浓度为( )
A. 5.0 mol/L B. 0.50 mol/L C. 1.0 mol/L D. 0.10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是

A. 图中A→B的过程为放热过程
B. 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C. 该反应为氧化还原反应
D. 1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com