
分析 (1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气;
(2)根据热化学方程式计算相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时产生的热量之比;
(3)根据氢气的燃烧的产物及来源分析回答.
解答 解:(1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气,反应方程式为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)根据热化学方程式可知,相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时产生的热量之比为2220.0kJ•mol-1:282.57kJ•mol-1=2220:283,故答案为:2220:283;
(3)氢气具有可燃性,燃烧的产物是水无污染,可以用水制取氢气,来源广,故答案为:来源广泛、产物无污染.
点评 本题考查热化学方程式的书写及有关计算和能源,难度中等,注意理解热化学方程式的意义与盖斯定律.


科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸馏、萃取 | B. | 过滤、结晶、升华 | C. | 分液、溶解、萃取 | D. | 溶解、过滤、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
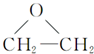 +CaCl2+H2O
+CaCl2+H2O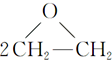
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含有碳、氢元素的有机物叫烃 | B. | 甲烷是最简单的有机物 | ||
| C. | 乙烷、丙烷均不存在同分异构体 | D. | 含碳元素的物质都是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe作负极,发生氧化反应 | |
| B. | 放电时,NiO2作正极,发生还原反应 | |
| C. | 蓄电池的电极应浸入碱性电解质溶液中 | |
| D. | 充电时,充电机的正极接在该蓄电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族金属元素是同周期中金属性最强的元素 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | VIIA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com