

| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
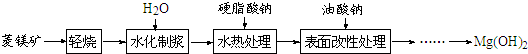
分析 菱镁矿(主要成分为MgCO3)轻烧,得到MgO,加入水有Mg(OH)2生成,加入硬质酸钠最终得到氢氧化镁固体,
(1)由图1可知,25℃时随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加,图2中温度为90℃,水化速率明显加快;
(2)氧化镁与水的化合反应为放热反应;
(3)由表可知,LiOH、NaOH、KOH,Mg(OH)2、Ca(OH)2、Ba(OH)2金属离子半径越大,氢氧化物越难分解;
(4)①根据Mg(OH)2受热分解的反应热及其氧化物的熔点分析;
②根据生成的产物是否环保分析.
解答 解:(1)由图1可知,25℃时随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加,图2中温度为90℃,水化速率明显加快;
故答案为:随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加;温度升高,水化反应速率加快;
(2)MgO+H2O═Mg(OH)2为放热反应,反应能自发进行;
故答案为:△H<0;
(3)由表可知,LiOH、NaOH、KOH,Mg(OH)2、Ca(OH)2、Ba(OH)2金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等);
故答案为:金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等);
(4)①Mg(OH)2受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧;且同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,使阻燃效果更佳;
故答案为:Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳;
②常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)高温时有烟生成,且高温时受热分解产生有毒、有害的污染物,无机类的氢氧化镁具有无烟、无毒、腐蚀性小等优点;
故答案为:无烟、无毒、腐蚀性小.
点评 本题考查了物质的制备和物质的性质,涉及对工艺流程的理解、对条件的控制选择与理解、环境保护等知识点,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,注意把握物质性质以及对题目信息的获取于使用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯的结构式:H2C=CHCl | B. | S2-的结构示意图: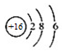 | ||
| C. | 熟石膏的化学式:2CaSO4•H2O | D. | 二氧化碳的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池中Zn为负极,发生还原反应 | |
| B. | 该电池的正极反应式为MnO2+e-+H2O=MnOOH+OH- | |
| C. | 导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn | |
| D. | 电池工作时内电路中OH-移动向MnO2一极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
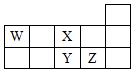
| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 氢氧化钠 | C. | 氢氧化钡 | D. | 氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
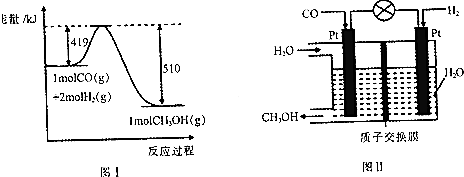
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 溶液中不一定含有SO42- |
| B | 向装有Fe(NO3)2溶液试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Be+ |
| D | 向淀粉溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2溶液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com