
| A. | 1mol•L-1 | B. | $\frac{100ρ}{103.65}$mol•L-1 | ||
| C. | $\frac{ρ}{103.65}$mol•L-1 | D. | 无法确定 |
分析 根据n=$\frac{V}{{V}_{m}}$计算氯化氢气体的物质的量,再根据m=nM计算氯化氢气体的质量,根据m=ρV计算水的质量,溶液质量=气体质量+水的质量,利用V=$\frac{m}{ρ}$来计算溶液的体积,根据c=$\frac{n}{V}$计算该气体的物质的量浓度.
解答 解:标准状况下,2.24L氯化氢的物质的量为:n(HCl)=$\frac{2.24L}{22.4L/mol}$=0.1mol,氯化氢气体的质量为:m(HCl)=0.1mol×36.5g/mol=3.65g,
所以溶液的质量为:100mL×1g/mL+3.65g=g=103.65g,
所以溶液的体积为:$\frac{103.65g}{1000ρg/L}$=$\frac{103.65}{1000ρ}$L,
则该溶液的物质的量浓度为:$\frac{0.1mol}{\frac{103.65}{1000ρ}L}$=$\frac{100ρ}{103.65}$mol/L.
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,注意熟练掌握物质的量浓度的概念及表达式,解答关键是正确计算溶液的体积,不能把溶剂的体积当做溶液的体积.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,写出戊的电子式
,写出戊的电子式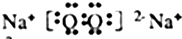 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能跟硝酸发生化合反应 | |
| B. | 能跟硝酸发生酯化反应 | |
| C. | 能跟乙酸反应生成乙酸酯 | |
| D. | 1mol单糖单元必定和3mol硝酸发生反应,少于3mol则不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com