
【题目】下列实验操作能达到实验目的的是( )
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的![]()
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将![]() 与
与![]() 混合气体通过饱和食盐水可得到纯净的
混合气体通过饱和食盐水可得到纯净的![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)![]() 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是 ( )
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是 ( )
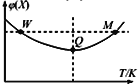
A. Q点时,Y的转化率最大
B. 升高温度,平衡常数增大
C. W点X的正反应速率等于M点X的正反应速率
D. 平衡时充入Z,达到新平衡时Z的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中不正确的是
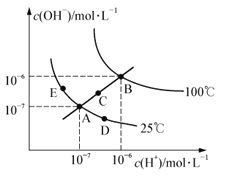
A.图中五点的KW间的关系为:B>C>A=D=E
B.若从A点到D点,可采用:恒温条件下,在水中加入少量的醋酸,提高溶液酸性
C.若从A点到C点,可采用:恒温条件下,在水中加入少量的醋酸铵,促进水的电离
D.100℃时,将pH=2的硫酸与0.01mol·L-1的KOH溶液等体积混合后,溶液中c(H+)=c(OH-)=10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)硫酸钙来源于烟气脱硫、磷酸盐工业和其他工业的副产品,可用于生成硫酸及其硫化物等。硫酸钙在高温下被CO还原,发生的反应有:
I.CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △Hl 平衡常数K1
CaS(s)+4CO2(g) △Hl 平衡常数K1
II.CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
III.3CaSO4(s)+CaS(s) ![]() 4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
(1)△H3=___(用△H1、△H2表示);平衡常数K3=_______(用K1、K2表示)。
(2)上述反应的平衡常数的对数值(lgK)与温度(T)的关系如下图所示:
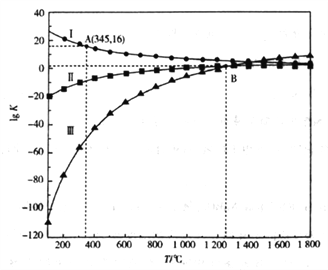
①△H1_________0(填”>”或”<")。
②若只发生反应I,A点c(CO)/c(CO2)=__________(填数值)。
③若只发生反应II和III,B点c(CO)、c(CO2)及c(SO2)之间的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.Na2SiO3易溶于水,可作木材防火剂B.NH3呈碱性,可用作制冷剂
C.Fe粉有还原性,可用作食品抗氧化剂D.漂白粉溶液呈无色,可用作消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4(草酸)是一种无色晶体,易溶于水,熔点为182℃,150~160℃升华,189.5℃分解。25℃时,Ka1=6×10-2,Ka2=6.4×10-5,Ksp(CaC2O4)=4.0×10-9。某校甲、乙、丙3个学习小组设计实验探究草酸的化学性质。
(1)草酸中所含官能团的名称为__________;
反应Ca2+(aq)+H2C2O4(aq)![]() CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
(2)甲组同学在Na2CO3溶液中加入少量草酸溶液产生大量气体,他们查得H2CO3的Ka1=4.47×10-7,Ka2=4.68×10-11,则发生反应的离子方程式为______________。
(3)乙组同学在酸性KMnO4溶液中逐滴加入草酸溶液,溶液紫色逐渐褪去,说明草酸具有_____性,反应中氧化产物与还原产物的物质的量之比为_________。
(4)丙组同学设计下列装置分解H2C2O4并设计实验装置检验产物中的CO2和CO。
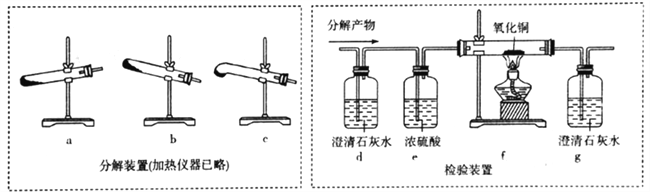 ①分解H2C2O4装置中最好的是__________(填字母)。
①分解H2C2O4装置中最好的是__________(填字母)。
②d中澄清石灰水变浑浊,能否说明有CO2生成? ___(填“能“或“不能”,下同),理由是________;仅依据装置g中澄清石灰水变浑浊,能否说明有CO生成?_________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是

A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为![]() <a<1
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有(1)乙酸乙酯和乙酸钠溶液、(2)溴化钠和溴水的混合液,分离它们的正确方法依次是( )
A. 分液、萃取 B. 萃取、分液 C. 分液、蒸馏 D. 蒸馏、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com