
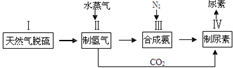
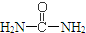 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.分析 (1)根据影响化学反应速率的因素判断,一般增大浓度、增大压强、升高温度,反应的反应速率增大;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)尿素中含有C、H、O、N四种元素,形成有离子键的物质,则有铵根离子,根据同分异构体的特点写出有关化学式;
(4)根据元素守恒及题中的反应物和生成物写出化学方程式,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反,可写出电极反应式;
(5)根据化学方程式,利用元素守恒,可计算出尿素的质量.
解答 解:(1)根据影响化学反应速率的因素可知,升高温度和加入催化剂都可以增加反应速率,充入氦气各物质的浓度没变,所以反应速率不变,减小压强反应速率减小,
故答案为:ac;
(2)根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2 $\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓,
故答案为:2NH4HS+O2 $\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓;
(3)尿素中含有CHON四种元素,形成有离子键的物质,则有铵根离子,根据同分异构体的特点写出有关化学式为NH4OCN,
故答案为:NH4OCN;
(4)根据元素守恒及题中的反应物和生成物写出化学方程式为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式为CH3CH2OH-12e-+16OH-═2CO32-+11 H2O,
故答案为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O;CH3CH2OH-12e-+16OH-═2CO32-+11H2O;
(5)根据化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g) 和 CO(g)+H2O(g)=?CO2(g)+H2(g),CO2+2NH3$\stackrel{一定条件}{→}$CO(NH2)2+H2O,及元素守恒可知CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2,
根据CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2
16 80
100t×80% xt
x=$\frac{80×100×80%}{16}$t=400t
故答案为:400.
点评 本题主要考查了影响化学反应速率因素、化学方程式的书写、根据化学方程式的计算等知识,有一定的综合性,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 类铅元素原子的最外层电子数为6 | B. | 其常见价态为+2、+3、+4 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 苯含有6 NA个C-H键 | |
| B. | 常温常压下,22.4 L H2O含有3NA个原子 | |
| C. | 1L 0.1 mol•L-1NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 23g Na与足量H2O反应完全共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯分子中含碳碳双键 | B. | 油脂的皂化反应属于加成反应 | ||
| C. | 丁烷有3种同分异构体 | D. | 以淀粉为原料可以制备乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com