
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、浓度均为0.1mol?L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B、为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D、常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1mol/L氯化镁溶液④0.1mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法正确的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法正确的是( )| A、反应2NO2(g)?N2O4(g)的正反应为吸热反应 |
| B、上述过程中,A烧瓶内正反应速率加快,逆反应速率减慢 |
| C、上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
| D、上述过程中,A烧瓶内气体密度减小、B烧瓶内气体密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电池放电后,电池中溶液的pH变大 |
| C、电池充电时,阴极反应为:Pb-2e-+SO2-4=PbSO4 |
| D、电池充电时,把铅蓄电池的正极与外电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| v(N2) |
| v(O2) |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
- 3 |
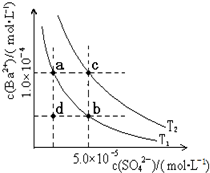
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgSO4 |
| B、Ba(HCO3)2 |
| C、Mg(HCO3)2 |
| D、Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com