
分析 (1)17.4g二氧化锰和37%浓盐酸200mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.2mol,浓盐酸中氯化氢物质的量=$\frac{200ml×1.19g/ml×37%}{36.5g/mol}$=2.4mol;盐酸中氯化氢过量,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据二氧化锰计算氯气物质的量为0.2mol,所以标准状况下,氯气的体积为4.48L;
(2)根据Ag++Cl-=AgCl↓,而溶液中的氯离子的物质的量是:2.4mol-0.2mol×2=2mol,所以氯化银的物质的量为2mol,从而求出质量.
解答 解:(1)17.4g二氧化锰和37%浓盐酸200mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.2mol,浓盐酸中氯化氢物质的量=$\frac{200ml×1.19g/ml×37%}{36.5g/mol}$=2.4mol;盐酸中氯化氢过量,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据二氧化锰计算氯气物质的量为0.2mol,所以标准状况下,VCl2=4.48L,答:生成的氯气在标准状况下体积为4.48L;
(2)根据Ag++Cl-=AgCl↓,而溶液中的氯离子的物质的量是:2.4mol-0.2mol×2=2mol,所以氯化银的物质的量为2mol,m(Ag Cl)=143.5g/mol×2mol=287g,答:生成的沉淀质量为287g.
点评 本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
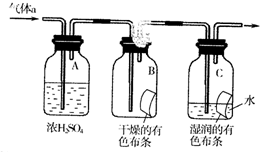 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: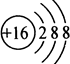 | |
| B. | 氨气(NH3)中氮元素的化合价:+3 | |
| C. | 氧化铁的化学式:FeO | |
| D. | 碳酸氢钠电离方程式:NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: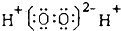 | |
| B. | 次氯酸的电子式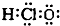 | |
| C. | N2的结构式:N≡N | |
| D. | 熔融时NaHSO4的电离方程式为:NaHSO4=Na++H++$S{{O}_{4}}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
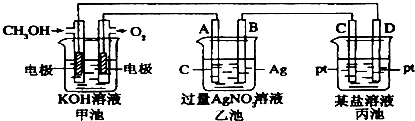
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com