
| A.25℃时,0.1 mol·L-1 HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 | D.该体系中HF与CaCl2反应产生沉淀 |
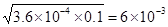 mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ksp只与难溶电解质本身的性质和温度有关 |
| B.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数 |
| C.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大 |
| D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (NH4)2S2O8 + H2↑
(NH4)2S2O8 + H2↑

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下在水中的溶解能力:AgCl>AgBr>AgI |
| B.在AgCl饱和溶液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成 |
| D.在AgI饱和溶液中加入NaI固体有AgI沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Zn2+ | C.Cr3+ | D.Mg2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com