
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
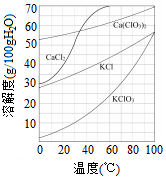 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
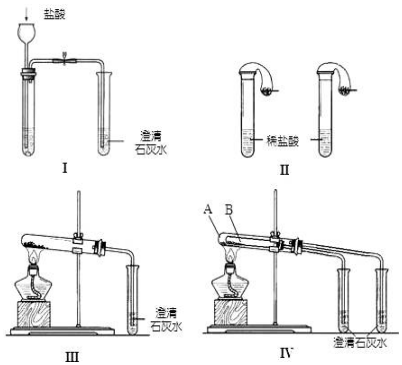
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com