

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 若 Zn与该硫酸反应消耗13克Zn,一定产生4.48升气体 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
分析 A.根据c=$\frac{1000ρω}{M}$计算该浓硫酸的物质的量浓度;
B.没有告诉在标准状况下,无法计算生成气体体积;
C.根据稀释定律计算需要浓硫酸的体积;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此判断.
解答 解:A.该硫酸溶液的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.没有告诉是标准状况下,不能使用标准状况下的气体摩尔体积计算生成气体的体积,故B错误;
C.设配制200mL4.6mol•L-1的稀硫酸需取该硫酸的体积为xL,根据溶液稀释前后溶质的物质的量不变,则0.2L×4.6mol/L=x×18.4nol/L,解得:x=0.05L=50mL,故C正确;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;
故选C.
点评 本题考查溶液浓度的计算与比较,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意硫酸的浓度越大,密度越大,注意利用定义式进行分析判断.


科目:高中化学 来源: 题型:选择题
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质在固态时均为离子晶体 | |
| B. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| C. | 用道尔顿的原子结构理论无法解释同位素现象 | |
| D. | 晶体类型相同,则晶体中化学键也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
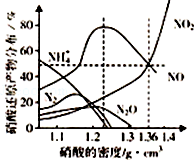 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法错误的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法错误的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液C(H+)=0.1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种单质分子和一种化合物分子 | B. | 一种阳离子和一种阴离子 | ||
| C. | 两种不同的阳离子 | D. | 两种不同的阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
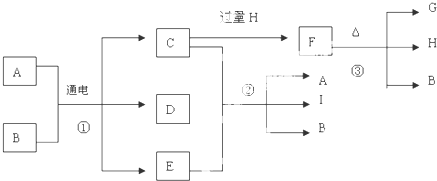
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | 澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com