
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
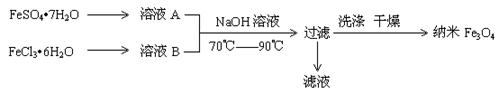
| A.保存溶液A时,应加入少量铁粉 |
| B.其制备反应类型不属于氧化还原反应 |
| C.取滤液进行焰色反应,火焰为黄色 |
| D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
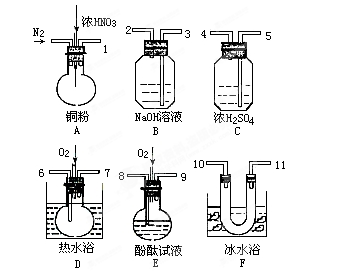
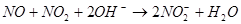
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
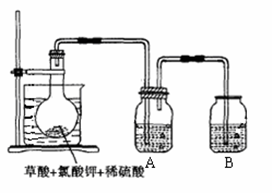
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
|
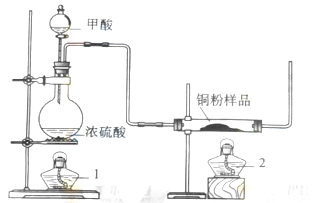 .(1)制备一氧化碳的化学方程式是 ;
.(1)制备一氧化碳的化学方程式是 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
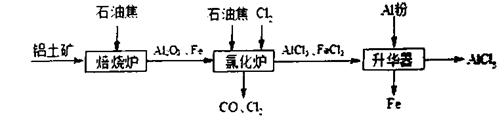
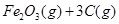
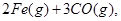
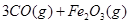

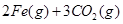 。则反应②的平衡常数的表达式为K= 。
。则反应②的平衡常数的表达式为K= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com