
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2$\stackrel{空气中灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
分析 A.FeS2和氧气反应生成二氧化硫;
B.电解氯化钠溶液生成氢氧化钠;
C.铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在空气中灼烧可生成氧化铁;
D.氯化铁和铜反应生成氯化铜、氯化亚铁.
解答 解:A.FeS2和氧气反应生成二氧化硫,不能直接生成三氧化硫,二氧化硫和氧气在催化作用下可生成三氧化硫,故A错误;
B.电解氯化钠溶液生成氢氧化钠,工业可用电解氯化钠可生成钠,故B错误;
C.铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在空气中灼烧时氢氧化亚铁生成氢氧化铁,分解可生成氧化铁,故C正确;
D.氯化铁和铜反应生成氯化铜、氯化亚铁,不能置换出铁,故D错误.
故选C.
点评 本题考查物质之间的转化,为高频考点,明确元素化合物性质及其转化关系是解本题关键,注意物质性质特殊性质,知道金属的冶炼方法与金属活泼性的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
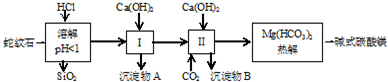
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
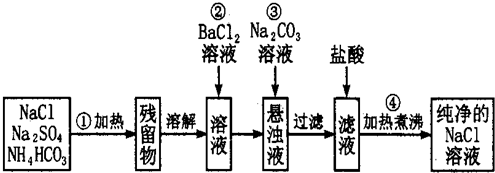
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
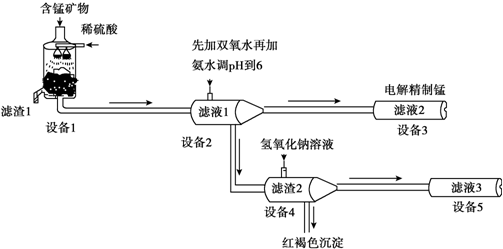
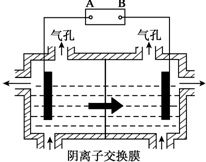 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 一种元素可能有多种氧化物,但同一化合价只对应一种氧化物 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com