
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
科目:高中化学 来源: 题型:
【题目】利用含多糖(淀粉)的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
![]()
![]() →
→![]() →
→![]() →
→![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)C中官能团的名称是______________________。
(2)B→C的反应类型是________________(填字母)。
A.取代反应 B.加成反应
C.氧化反应 D.还原反应
(3)写出由醋酸制备醋酸甲酯的化学反应方程式:
_______________________________________________________________________________。
(4)实验室由B可制备乙烯气体,写出将乙烯气体通入溴水中出现的现象:
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物![]() 的结构式如图所示。下列说法错误的是( )
的结构式如图所示。下列说法错误的是( )
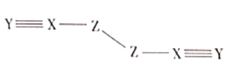
A.Z与W形成的化合物熔点高
B.Y与Z能形成多种化合物
C.X的氢化物的沸点一定小于Z的氢化物
D.化合物![]() 中所有原子均满足8电子稳定结构
中所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

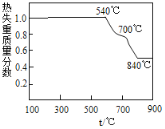
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物有着广泛的应用前景。回答下列问题:
(1)基态Co原子的核外电子排布式为_________.
(2)以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构简式如图所示。
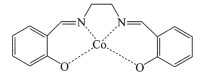
①配合物中提供孤对电子的原子是_________(填元素符号);
②该多齿配体中所含元素电负性由大到小的顺序为__________(填元素符号):
③下列化合物与上述配合物中C和N原子的杂化类型均相同的是__________(填标号)。
A.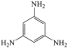 B.
B. C.
C. D.
D.
(3)亚硝酸钴钠可与K+结合形成K2Na[Co(NO2)6],从而实现对K+的定量测定。
①K2Na[Co(NO2)6]中存在的化学键类型有_________(填标号);
A.金属键 B.离子键 C.极性共价键 D.配位键
②与亚硝酸根互为等电子体的化合物有_________(写一种)。
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是____。
(5)某种铁酸钴(CoTiO3)晶胞沿x、y或z轴任意一个方向的投影如下图所示。晶胞中Co处于各顶角位置,则O处于_________位置,与Co紧邻的O的个数为_________。若晶胞中Co与O的距离为anm,阿伏加德罗常数的值为NA,该晶体的密度为_________g.cm-3(列出计算式)。
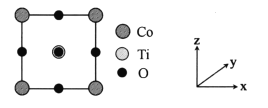
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
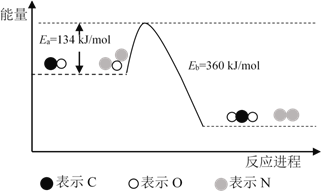
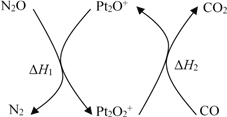
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:2X(s)+Y(g)![]() 2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )
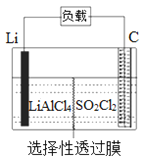
A. 电池工作时负极材料是Li,发生氧化反应
B. 电池工作时电子流向:锂电极→导线→负载→碳棒
C. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
D. 电池工作时,外电路流过0.2 mol电子,生成2.24 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com