
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
分析 (1)离子晶体中离子的半径越小,离子键强度越大,熔点越高;
(2)分子晶体的熔点与分子间作用力有关,相对分子质量越大,分子间作用力越强,熔点越高,所以硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与相对分子质量有关,随着相对分子质量增大,分子间作用力增强;
(3)一般离子晶体的熔点比分子晶体的熔点高.
解答 解:(1)离子晶体中离子的半径越小,离子键强度越大,熔点越高,所以钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的半径有关,随着半径的增大,熔点逐渐降低;故答案为:离子半径大小;
(2)分子晶体的熔点与分子间作用力有关,相对分子质量越大,分子间作用力越强,熔点越高,所以硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与相对分子质量有关,随着相对分子质量增大,分子间作用力增强,故熔点逐渐升高,故答案为:相对分子质量;分子间作用力;
(3)一般离子晶体的熔点比分子晶体的熔点高,因为钠的卤化物为离子晶体,硅的卤化物为分子晶体,所以故前者的熔点远高于后者,故答案为:晶体类型.
点评 本题考查了晶体类型与晶体熔点的关系,根据影响晶体熔点的因素分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:NO、CO2、SO2、Na2O2 | |
| B. | 碱:NaOH、KOH、Ca(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、NH4HCO3、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Al2O3、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
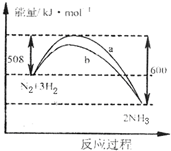
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 mol N2和3 mol H2充分反应后,放出92 kJ热量 | |
| C. | 加入催化剂可增大正反应速度,降低逆反应速率 | |
| D. | b曲线是加入催化剂时的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
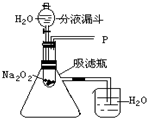 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中的Na2O2既表现氧化性,又表现还原性 | |
| B. | 反应每消耗1molSO2,Na2O2将得到2mol电子 | |
| C. | 与反应2Na2O2+CO2═2Na2CO3+O2中Na2O2的作用相同 | |
| D. | 与反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2的作用相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com