
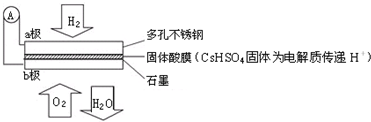
| A. | 电子通过外电路从a极流向b极 | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 电池工作时每转移0.1 mol电子,消耗1.12 LH2 | |
| D. | b极上的电极反应式为:O2+4H++4e-=2H2O |
分析 根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,以此解答该题.
解答 解:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,
A.a为负极,b是正极,则电子应该是通过外电路由a极流向b,故A正确;
B.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故B正确;
C.每转移0.1mol电子,消耗0.05mol的H2,但气体存在的条件未知,体积不一定为1.12 L,故C错误;
D.该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,故D正确.
故选C.
点评 该题是高考中的常见题型,属于中等难度的试题.侧重考查学生灵活运用原电池原理解决实际问题的能力.学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题.


科目:高中化学 来源: 题型:选择题
| A. |  用装置制取氯气 | |
| B. | 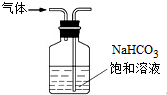 用装置除去氯气中混有的少量氯化氢 | |
| C. | 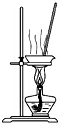 用装置蒸干氯化锰溶液制MnCl2•4H2O | |
| D. | 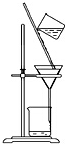 用装置分离二氧化锰和氯化锰溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低反应体系的压强 | B. | 增加反应物碳的用量 | ||
| C. | 缩小反应体系的体积 | D. | 减少体系中CO的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 微粒 | X | Y | Na+ | A- |
| 浓度/(mol•L-1) | 8.00×10-4 | 2.50×10-10 | 0.100 | 9.92×10-2 |
| A. | 0.1mol•L-1HA溶液的pH=1 | B. | 该温度下Kw=1.0×10-14 | ||
| C. | 微粒X表示OH-,Y表示H+ | D. | 混合溶液中:n(A-)+n(X)=n(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•Lˉ1•sˉ1 | B. | 0.1 mol•Lˉ1•sˉ1 | ||
| C. | 0.2 mol•Lˉ1•sˉ1 | D. | 0.8 mol•Lˉ1•sˉ1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com