
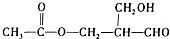 失去光学活性的是( )
失去光学活性的是( )| A. | H2 | B. | CH3COOH | C. | Cu/O2 | D. | Ag(NH3)2OH |
分析 根据题意知,手性碳原子连接4个不同的原子或原子团,如果反应后的生成物的碳原子上连接4个不同的原子或原子团,则其生成物就含有手性碳原子.
解答 解:物质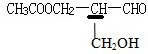 具有手性,是因为其中的划横线的碳有手性,
具有手性,是因为其中的划横线的碳有手性,
A.醛基能与氢气发生加成反应,生成醇,划线的碳原子上连接两个一样的-CH2OH结构,不再具有手性,故A错误;
B.乙酸中的羧基能与羟基发生酯化反应,划线的碳原子上连接两个一样的CH3COOCH2-结构,不再具有手性,故B错误;
C.醇羟基在铜存在的条件下与氧气反应发生氧化反应生成醛基,划线的碳原子上连接两个一样的-CHO结构,不再具有手性,故C错误;
D.与银氨溶液发生银镜反应后,醛基变为羧酸铵结构,划横线的碳原子仍然有手性,故D正确.
故选D.
点评 本题考查手性碳原子的判断,难度中等,手性碳原子判断注意:①手性碳原子一定是饱和碳原子;②手性碳原子所连接的四个基团要是不同的.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 反应类型 |
| A | 四氯化碳和苯酚都能使溴水褪色 | 取代反应 |
| B | 甲苯和甲酸都能使酸性高锰酸钾溶液褪色 | 氧化反应 |
| C | 一氯甲烷和乙醇都能制备乙烯 | 消去反应 |
| D | 聚乙烯和聚乙炔都能使溴的四氯化碳溶液褪色 | 加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C |
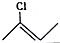 |  |  |
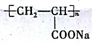 .
.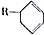 结构,D可能的结构有4种;写出
结构,D可能的结构有4种;写出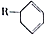 和Cl2发生1,4-加成反应的化学方程式:
和Cl2发生1,4-加成反应的化学方程式: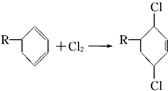 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
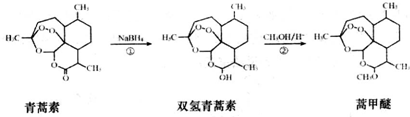
| A. | 青蒿素的分子式是C15H22O5,属于烃的衍生物 | |
| B. | 青蒿素难溶于水,而易溶于有机溶剂 | |
| C. | 反应②为取代反应,有H2O生成 | |
| D. | 青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容积为某一固定值,当体系的压强不再发生变化时说明达到化学平衡状态 | |
| B. | 若上述可逆反应达化学平衡状态后,给平衡体系加压(缩小容积,其他条件不变),则容器内气体的平均摩尔质量将减小 | |
| C. | 若上述可逆反应达到化学平衡状态后,升高温度(其他条件不变)体系颜色加深,则Q>0 | |
| D. | 对于上述可逆过程给平衡体系减压(增大容积,其他条件不变),可以提高N2O4的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
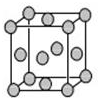 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com