
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
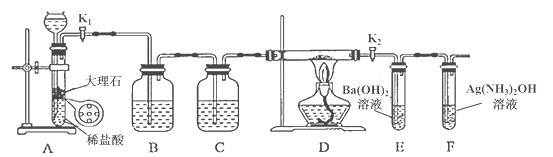
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
【答案】饱和碳酸氢钠溶液 d、a、b、f 、e、c 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 加入足量BaCl2溶液(或足量CaCl2溶液)后滴入酚酞试液(或测pH) 有白色沉淀产生,酚酞不变红(pH=7) 12Na+11CO2=6Na2CO3+C+4CO
【解析】
根据实验目的及反应装置,A为制备二氧化碳,使用的盐酸易挥发,则装置B为除HCl气体,但不能吸收二氧化碳,为饱和的碳酸氢钠溶液,装置C为浓硫酸,除去二氧化碳中的水蒸气;D为Na与二氧化碳的反应装置,装置E为除去未反应的二氧化碳,F为验证是否有CO生成。
(1)装置B为吸收HCl气体,且不能吸收二氧化碳,则溶液为饱和的碳酸氢钠溶液;
(2) Na能和空气中的氧气反应,则需先通入一定量的二氧化碳排净装置中的空气,再点燃酒精灯,使Na与二氧化碳反应;熄灭酒精灯,待装置恢复至室温时,关闭K1和K2 ,称量硬质玻璃管的质量,则答案为d、a、b、f 、e、c;
(3)根据实验现象,钠能在二氧化碳中燃烧,产生黄色火焰,且生成黑色的单质碳;
(4)若只有碳酸钠,向步骤1中加入氯化钡时,能产生溶于酸的白色沉淀和NaCl溶液,则在室温时溶液的pH为7;
(5)m(Na)=69.0-66.7=2.3g,固体增重为72.1-69.0=3.1g,根据Na原子守恒,碳酸钠的质量为5.3g,则C的质量为0.1g,n(Na2CO3):n(C)=![]() :
:![]() =6:1,则方程式为12Na+11CO2=6Na2CO3+C+4CO。
=6:1,则方程式为12Na+11CO2=6Na2CO3+C+4CO。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________________
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
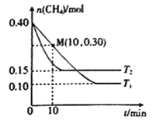
①根据图判断该反应的△H______0(填“>”、“<”或“=”)。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=_________ 。
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为HCl溶液,工作一段时间后,负极的电极反应式为________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________________;常温下,将amol/L的Ba(OH) 2 与bmol/L的HN3溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该溶液中c(HN3)=_________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
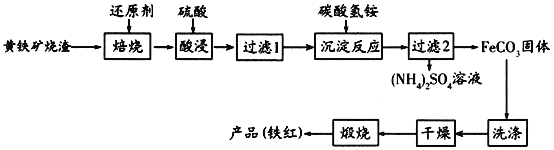
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
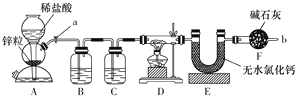
(1)装置B的作用是______________ ,装置C中盛装的液体是______________。
(2)在硬质双通玻璃管中发生的化学反应方程式是_______________________。
(3)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U型管的质量增加7.2 g,则混合物中Fe2O3的质量为______________。
(4)U型管E右边连接干燥管F的目的是________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: +4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。
+4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。

(1)e装置的作用是_______________;当观察到______________________________现象时,试管d中反应基本结束。
(2)若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________________________。
(3)实验结束后精制试管d中粗产品,操作先后顺序是___________________。
A.蒸馏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗
(4)实验消耗40%乙烯利溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为________________(列出含m的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L四氯化碳中含有的分子数0.5NA
B.常温常压下,18.0 g水所含的电子数为10 NA
C.300mL 0.1mol/L的NaCl的溶液含有0.03NA个NaCl分子
D.1.2 g熔融的NaHSO4含有阴阳离子总数为0.03NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com