
【题目】我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是( )
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象。
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
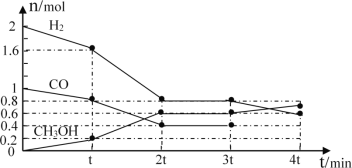
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=__。
②tmin至2tmin时速率变化的原因可能是__(要求答出所有可能原因)。
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的![]() 。请回答下列问题:
。请回答下列问题:
①SO2的转化率为__;
②达到平衡时反应放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方而获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示:
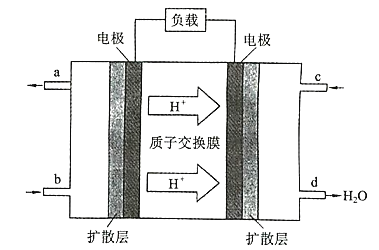
(1)该电池工作时,b处通入的物质为 ______________ ,c 通入 的物质为______。
(2)该电池负极的电极反应式为 _________________ 。
(3)工作一段时间后,当12.8g甲醇完全反应生成 CO2时时,有_________×6.02×1023个电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
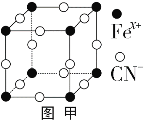
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
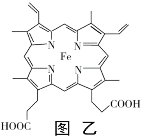
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________

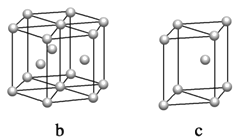
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量示意图,下列判断正确的是( )
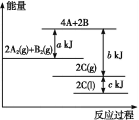
A.化学反应中断键要放出能量,形成化学键要吸收能量
B.该反应的反应物总能量小于生成物总能量
C.2A2(g)+B2(g)= 2C(g)ΔH=-(b+c-a)kJ·mol-1
D.由图可知,生成1 mol C(l),放出![]() (b+c-a)kJ热量
(b+c-a)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2 + O2![]() 2SO3 △H= -196.6kJ/mol
2SO3 △H= -196.6kJ/mol
B.N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
C.C(s)+O2(g)=CO2(g) △H= +393.5kJ/mol
D.H2O(l)==H2(g)↑+1/2O2(g)↑ △H= +285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com