
分析 Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O中,Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,以此来解答.
解答 解:(1)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为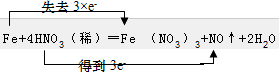 ,故答案为:
,故答案为: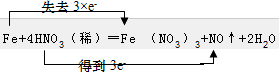 ;
;
(2)n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,Fe元素的化合价由0升高为+3价,则转移电子的物质的量为1.5mol,硝酸中N元素的化合价由+5价降低为+2价,被还原的硝酸的物质的量为0.5mol,
故答案为:1.5 mol;0.5mol;
(3)反应的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com