
【题目】以C2H2为原料合成环丁烯类化合物L的路线如下:
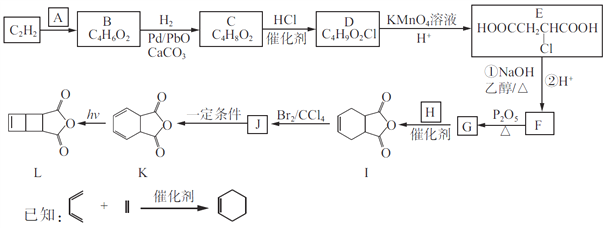
(1)A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为____________。
(2)B分子中的碳原子都在同一直线上,B的结构简式为________________。
(3)C→D、J→K的反应类型分别为________________、________________。
(4)设计C→D、E→F两步反应的目的是________________________。
(5)G和H生成I的化学方程式为______________________。
(6)化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2,X共有__种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为____________________。
(7)写出用![]() 和乙炔为原料制备
和乙炔为原料制备![]() 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
【答案】 甲醛 HOCH2-C≡C-CH2OH 加成反应 消去反应 保护碳碳双键不被氧化 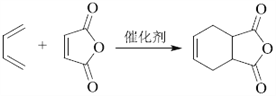 13
13 ![]()

【解析】试题分析:A由碳、氢、氧三种元素组成,相对分子质量是30,则A是HCHO;C2H2与HCHO反应生成B,根据B的分子式C4H6O2,可知C2H2与HCHO反应是加成反应,结合E的结构简式,B是HOCH2-C≡C-CH2OH;HOCH2-C≡C-CH2OH与氢气1:1发生加成反应生成C4H8O2,则C是HOCH2-CH=CH-CH2OH;HOCH2-CH=CH-CH2OH与HCl发生加成反应生成C4H9O2Cl,C4H9O2Cl的结构简式是HOCH2-CH2CHCl-CH2OH;HOCH2-CH2CHCl-CH2OH被氧化为![]() ;
;![]() 在氢氧化钠的醇溶液中发生消去反应生成F,则F是HOOC-CH=CH-COOH;由I逆推G是
在氢氧化钠的醇溶液中发生消去反应生成F,则F是HOOC-CH=CH-COOH;由I逆推G是![]() ,H是
,H是![]() ;
;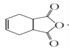 与溴的四氯化碳溶液发生加成反应生成J,则J是
与溴的四氯化碳溶液发生加成反应生成J,则J是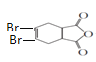 ,
, 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成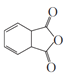 。
。
解析:根据以上分析,(1)A是HCHO, A的名称为甲醛。 (2) C2H2与HCHO反应是加成反应生成B,B的结构简式为HOCH2-C≡C-CH2OH。 (3) HOCH2-CH=CH-CH2OH与HCl发生加成反应生成HOCH2-CH2CHCl-CH2OH、J→K是 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成 。 (4)碳碳双键易被氧化,设计C→D、E→F两步反应的目的是保护碳碳双键不被氧化。 (5)
。 (4)碳碳双键易被氧化,设计C→D、E→F两步反应的目的是保护碳碳双键不被氧化。 (5) ![]() 和
和![]() 发生加成反应生成
发生加成反应生成 的化学方程式为
的化学方程式为 。 (6)与FeCl3溶液发生显色反应,说明含有苯环和酚羟基,且能与NaHCO3溶液反应放出CO2,说明含有羧基,符合条件的I的同分异构体若苯环上有
。 (6)与FeCl3溶液发生显色反应,说明含有苯环和酚羟基,且能与NaHCO3溶液反应放出CO2,说明含有羧基,符合条件的I的同分异构体若苯环上有![]() 三个取代基有10种结构,若有
三个取代基有10种结构,若有![]() 两个取代基有3种结构,共有13种结构;其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为
两个取代基有3种结构,共有13种结构;其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为![]() 。
。
(7) 与甲醇发生酯化反应生成
与甲醇发生酯化反应生成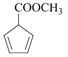 ,
, 再与乙炔发生反应生成
再与乙炔发生反应生成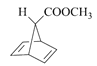 ,
, 在光照条件下生成
在光照条件下生成![]() ,所以合成路线为
,所以合成路线为
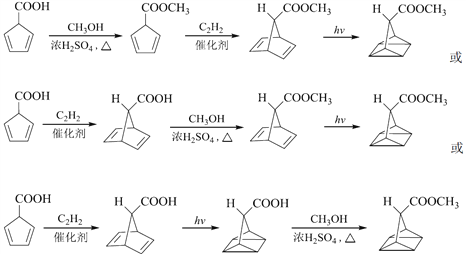 。
。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
A. P—P键的键能大于P—Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl—Cl键的键能为![]() kJ·mol-1
kJ·mol-1
D. P—P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
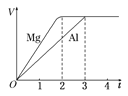
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
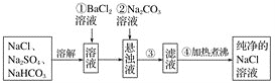
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
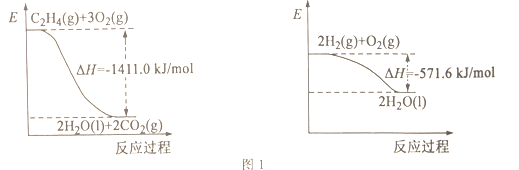
【题目】大气中CO2含量的增加会加剧温室效应,秉承“低碳环保,绿色出行”的生活理念,CO2的综合利用也成为热门研究领域。
I.CO2可用于生产乙烯。
(1)依据图1写出CO2和H2生成C2H4和H2O(l)的热化学方程式________。
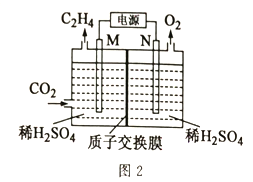
(2)以稀硫酸作电解质溶液,利用电解法将CO2转化为乙烯的装置如图2所示。M电极的电极反应式为_____,工作一段时间后,阳极室中溶液的pH_____(填“增大”“不变”或“减小”)。
Ⅱ.CO2与H2在一定条件下可生产二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)Δ H<0
CH3OCH3(g)+3H2O(g)Δ H<0
(3)在2.0L恒容密闭容器中,加入2.0molCO2和6.0molH2,恒温条件下经过5min达到平衡状态,此时的压强是起始压强的2/3
①0~5min内反应的平均速率v(H2)=____,此温度下的平衡常数K=______.
②平衡常数K(800K)______K(900K)(填“>”“=”或“<”)
(4)分别以Cat.1和Cat.2作催化剂发生该反应,反应进行相同的时间后,测得CO2的转化率a(CO2)随反应温度T的变化情况如图3所示(忽略温度对催化剂活性的影响)。
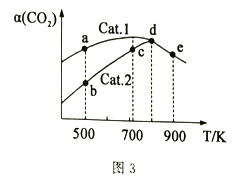
①该反应的活化能Ea(Cat.1)________Ea(Cat.2)(填“>”或“<”)。
②a、b、c、d、e五个状态中一定是平衡状态的是_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
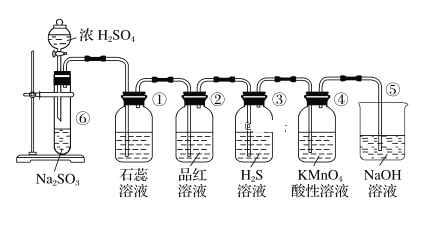
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2具有____________性。。
(4)③中的实验现象是_______________________,证明SO2有____________性。
(5)④中的实验现象是______________________,证明SO2有_____________性。
(6)⑤装置的作用是___________________________,该反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com