
| A. | 苯酚显弱酸性,它能与氢氧化钠溶液反应 | |
| B. | 在苯酚钠溶液中通入二氧化碳气体,可得到苯酚 | |
| C. | 除去苯中混有的少量苯酚,可用溴水作试剂 | |
| D. | 苯酚有毒,但药皂中掺有少量苯酚 |
分析 A、由于苯环使-OH活化,从而苯酚显弱酸性;
B、苯酚的酸性弱于碳酸;
C、苯酚和溴水反应生成的溴苯能溶于苯中;
D、苯酚能用于杀菌消毒.
解答 解:A、由于苯环使-OH活化,-OH能电离出从而苯酚显弱酸性,能与氢氧化钠溶液反应,故A正确;
B、苯酚的酸性弱于碳酸,故苯酚钠溶液中通入二氧化碳气体,能将苯酚制出来,故B正确;
C、苯酚和溴水反应生成的溴苯能溶于苯中,故加入溴水虽然能和苯酚反应,但会生成新的杂质三溴苯酚,故C错误;
D、苯酚能用于杀菌消毒,故在药皂中要加入苯酚,故D正确.
故选C.
点评 本题考查了苯酚的性质以及用途,难度不大,易错点是C,应注意的是除去苯中的苯酚应用氢氧化钠溶液,然后分液即可.


科目:高中化学 来源: 题型:选择题
| A. | A、需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应中的能量变化除了热量外还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化服从能量守恒定律 | |
| D. | 生成物的总能量小于反应物的总能量时发生的是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




 ;W2Z
;W2Z .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜屑与浓硫酸混合加热 | |
| B. | 铜屑在空气中灼烧后再溶于稀H2SO4 | |
| C. | 铜屑与稀硫酸混合加热 | |
| D. | 铜屑在空气中灼烧后再溶于浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
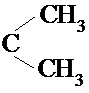 ,CH3CH2CH═O+O═
,CH3CH2CH═O+O═
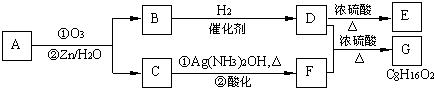
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度之比为c(M):c(N):c(P)=2:2:3 | |
| B. | 平衡混合物体积是反应开始前的$\frac{3}{5}$ | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了 a mol M 物质,则同时也消耗了 1.5a mol P 物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
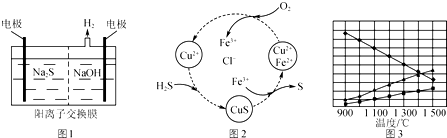
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com