
向四支盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如下图所示:
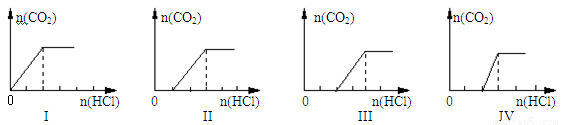
则下列分析都正确的组合是
选项 | 溶质的成分 | 对应图象 | 溶液中离子浓度关系 |
A | NaHCO3 | I | c(Na+) = c(HCO3-) |
B | NaOH、Na2CO3 | Ⅳ | c(OH-)>c(CO32-) |
C | Na2CO3 | Ⅲ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
D | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)>c(HCO3-) |
B
【解析】
试题分析:A、根据图1可判断加入盐酸立即产生气体,说明溶液中溶质是碳酸氢钠,由于碳酸氢根存在水解和电离,则溶液中c(Na+) > c(HCO3-),A错误;B、如果溶质是氢氧化钠和碳酸钠,则加入盐酸后首先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,最后与碳酸氢钠反应生成CO2和水,图像Ⅳ符合。根据图像可知氢氧化钠与碳酸钠的物质的量相等,当由于碳酸根水解,则溶液中c(OH-)>c(CO32-),B正确;C、如果溶质只有碳酸钠,则加入盐酸后碳酸钠与盐酸反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应放出CO2,由于两次消耗的盐酸相等,则图像Ⅲ不符合,且根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),C错误;D、如果溶质是碳酸钠和碳酸氢钠的混合物,则加入盐酸后碳酸钠与盐酸反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应放出CO2,图像Ⅱ符合。根据图像可知碳酸钠与碳酸氢钠的物质的量是相等的,当由于碳酸根的水解程度大于碳酸氢根的水解程度,因此溶液中c(CO32-)<c(HCO3-),D错误,答案选B。
考点:考查碳酸盐与盐酸反应的图像分析以及溶液中离子浓度大小比较


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色,苯和溴水发生取代反应,使溴水褪色 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生,蛋白质发生了变性 |
D | C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中物质的量浓度为( )
A.1.4×10-6 mol·L-1 B.2.3×10-6 mol·L-1
C.1.4×10-9 mol·L-1 D.2.3×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:实验题
(11分)某研究性小组对Fe3+ 与S2-的反应有不同的看法,
(1)猜想可能发生三种反应情况:双水解反应;氧化还原反应; ;(填反应类型)。
针对上述猜想该小组做了如下探究实验:
序号 | 实验操作 | 现象 |
① | 向大试管中加入20mL 0.1molL-1的Na2S溶液 (已知Na2S溶液显碱性,pH约为12),再滴加5mL 0.1molL-1的FeCl3溶液,边滴边振荡 | 产生大量黑色沉淀,反应后溶液仍显碱性 |
② | 向另一支大试管中加入20mL 0.1molL-1FeCl3溶液(已知FeCl3溶液显酸性,pH约为2),再滴加5mL 0.1 molL-1的Na2S溶液,边滴边振荡 | 局部有黑色沉淀但瞬间消失,溶液颜色变浅,并产生大量黄色浑浊,反应后溶液仍显酸性 |
【查阅资料】
Fe2S3是黑色或深黄绿色固体,中性或碱性很稳定,FeS是黑褐色的固体。
(2)根据实验现象和理论分析:实验①发生的离子反应方程式为: 。
实验②发生反应的离子方程式: 。
(3)设计实验验证实验②所发生的化学反应,检验对象是实验②所得混合物。
限选试剂:稀盐酸、NaOH溶液、CS2、KSCN溶液、酸性KMnO4溶液、H2O2。
实验操作 | 预期现象和结论 |
(4)综合分析实验①、②,影响Fe3+ 与S2- 的反应类型的可能因素有 ; 。(至少填两点)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是

A.该燃料电池负极发生的电极反应为:N2H4+4OH-4e-==N2↑+4H2O
B.用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4
C.该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧
D.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
利用下列实验装置图进行的相应实验,能达到实验目的的是
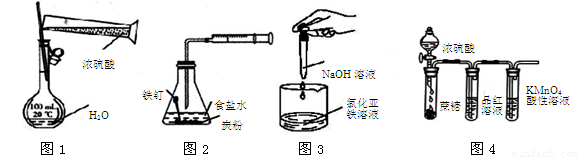
A.用图1装置配制一定物质的量浓度的稀硫酸
B.用图2装置可探究铁的吸氧腐蚀
C.用图3装置可制取氢氧化亚铁
D.用图4装置可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0
C.将碳酸钠溶液和碳 酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱
酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱
D.用FeCl3饱和溶液制Fe(OH)3胶体的过程属 于吸热过程
于吸热过程
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列说法中,不正确的是
A.高纯度的硅单质广泛用于制作光导纤维
B.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
C.开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量
D.严格执行“限塑令”是解决“白色污染”问题的重要途径
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com