
| A.加入AgNO3溶液有白色沉淀产生 |
| B.加入稀盐酸有无色无味气体产生,该气体可使澄清的石灰水变浑浊 |
| C.加入MgCl2溶液有白色沉淀产生,再加入稀盐酸沉淀溶解,并产生可使澄清石灰水变浑浊的无色无味气体 |
| D.加入Ba(OH)2溶液有白色沉淀产生 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
| B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
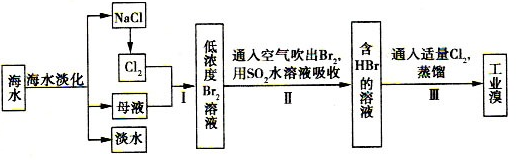
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
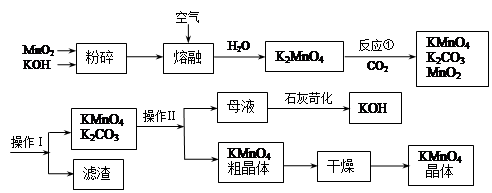
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液) |
| B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液) |
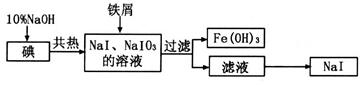
| C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液) |
| D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 将含有HCl杂质的CO2通入饱和Na2CO3溶液中 | 除去CO2中的HCl |
| B | 将一定量的KNO3和NaCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 分离出NaCl晶体 |
| C | 在含有少量FeCl3的MgCl2酸性溶液中加入足量MgO并过滤 | 除去溶液中的FeCl3 |
| D | 在含有少量Na2S的NaCl溶液中加入AgCl,再过滤 | 除去溶液中的Na2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
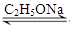 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
| | 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
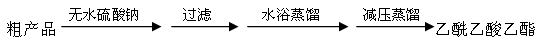
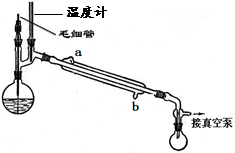
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KSCN | B.NaOH | C.HCl | D.BaCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
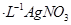 溶液滴定至终点,消耗
溶液滴定至终点,消耗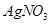 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com