

图15-5
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应的离子方程式是____________________________________。
(2)实验开始时应先将活塞E_________(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是___________________________。
(3)简述生成Fe(OH)2的操作过程____________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________。
解析:本题的制取原理是:A中铁屑与稀硫酸反应产生H2与FeSO4,H2只能从蒸馏烧瓶的支管再经活塞E处导出(因为另一导管的末端在A中已形成液封,气体无法导出),经B后用排水法收集。H2经过B时可将溶于NaOH溶液中的空气赶出,同时烧瓶A中也充满了H2,阻碍了FeSO4与空气接触。一段时间后,关闭活塞E,A中H2无法继续逸出,因而压强逐渐增大,将A中的溶液逐渐压入B中,这样FeSO4与NaOH反应生成了Fe(OH)2,在A装置中与空气隔绝,因而易于观察生成的Fe(OH)2?的颜色,拔去了B的橡皮塞,空气进入,Fe(OH)2被氧化为Fe(OH)3。
答案:(1)铁屑 Fe+2H+====Fe2++H2↑
(2)打开 H2
(3)关闭活塞E及分液漏斗上的活塞加入适量硫酸,硫酸与铁屑接触后产生气体。待收集到足量气体后关闭活塞E,此时A中液面逐渐沿导管上升并进入B中,产生Fe(OH)2沉淀
(4)4Fe(OH)2+O2+2H2O====4Fe(OH)3
讲评:本题着重实验原理设计的综合考查。在解析过程中,可运用“化整为零”的分解析题法,依据原理分解成三个关联的小实验:①FeSO4溶液的制取;②Fe(OH)2的制取;③Fe(OH)2的氧化。表示为:

由此确定答案。


科目:高中化学 来源: 题型:
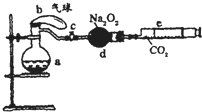 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占| 1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
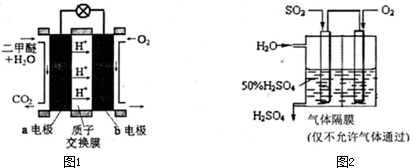
查看答案和解析>>
科目:高中化学 来源: 题型:

图15-11
(1)Q内发生化学反应时,生成的气体是_____________。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是__________,应当打开的是_____________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________________。
(4)b中装的固体试剂是___________,为什么要缓缓打K1__________________________。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体(已折算成标准状况),则过氧化钠的纯度的数学表达式是__________________________(需化成最简表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)
我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。
【查阅资料】KMnO4( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
【实验一】
按如图所示装置进行采样
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。
【实验二】
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
【实验三】
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
| 环境温度/℃ | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
(7)由该表可以得出的结论是
(8)请用化学反应原理解释
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:实验题
(15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。
【查阅资料】KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
【实验一】
按如图所示装置进行采样
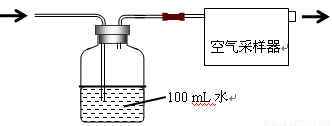
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。
【实验二】
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
【实验三】
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
|
环境温度/℃ |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
显色时间/min |
45 |
30 |
15 |
13 |
10 |
7 |
5 |
(7)由该表可以得出的结论是
(8)请用化学反应原理解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com