
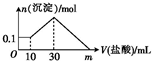
 某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )
某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )| A、60 | B、100 |
| C、120 | D、150 |
| 0.3mol |
| 5mol?L-1 |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、该反应属于置换反应 |
| B、氧化性:I2>KClO3 |
| C、还原性:KClO3>I2 |
| D、还原剂为I2,氧化剂为KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、精铜砂装载过多导致沉船 |
| B、运输途中铜与空气中的氧气发生氧化反应导致质量增大超过船的承载能力 |
| C、在潮湿的环境中,船体与铜构成了原电池,加速了作为负极的船体的腐蚀 |
| D、在潮湿的环境中,船体与铜构成了电解池,钢制船体作阳极而被氧化腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
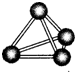 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )| A、N4分子属于一种新型的化合物 |
| B、N4分子中只含有非极性键 |
| C、1 mol N4分子所含共价键数为4NA |
| D、N4沸点比P4(白磷)高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油干馏可得到汽油、煤油等 |
| B、硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 |
| C、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液等多种方法鉴别 |
| D、糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1.5mol N2被氧化的气体有3mol |
| B、处理过程中转移的电子数目约为1.339Na |
| C、NOx中x的数值为1.2 |
| D、出去废气中的NOx至少需要氨0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
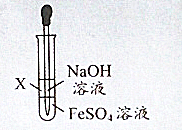
| A、该实验中NaOH溶液往往事先煮沸下,目的是为了赶走其中溶有的O2 |
| B、试剂X可以是食用油、苯或乙醇 |
| C、该实验能较长时间观察到白色沉淀的现象 |
| D、该反应的离子方程式为:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电子式 可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B、填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、原子结构示意图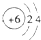 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com