
| 1 |
| 2 |
| 1 |
| 2 |
0.001×
| ||
| 400 |
| 2mol×71g/mol |
| 1mol(111g/mol+143g/mol) |
| 2mol×71g/mol |
| 1mol(111g/mol+143g/mol) |
| 71×3 |
| 74+3(74.5+51.5)+18n |


科目:高中化学 来源: 题型:

| 高温 |
| 高温 |
| c(Br-) |
| c(Cl-) |
| c(Br-) |
| c(Cl-) |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
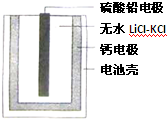 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb;下列有关说法正确的是(Pb的相对原子质量:207)( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb;下列有关说法正确的是(Pb的相对原子质量:207)( )| A、正极反应式:Ca+2Cl--2e-=CaCl2 |
| B、常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C、放电过程中,Li+向负极移动 |
| D、每转移0.1mol电子,理论上生成20.7g Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SO2、O2 |
| B、CO2、N2、O2 |
| C、SO2、NO2、可吸入颗粒物 |
| D、NO2、N2、可吸入颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、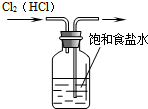 除去Cl2中的HCl杂质 |
B、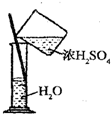 稀释浓硫酸 |
C、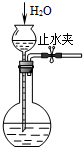 检查装置气密性 |
D、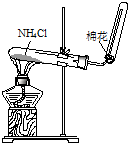 实验室制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com