
室温下,体积为2 L的密闭容器中A、B、C三种气体的起始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法中正确的是 ( )。
A.发生的反应可表示为A+B2C
B.反应达到平衡时B的转化率为25%
C.若起始时密闭容器中有0.1 mol A、0.1 mol B、0.2 mol C时,反应达平衡时,c(A)=0.05 mol·L-1
D.改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数
科目:高中化学 来源: 题型:
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):

(1)A的类别是________,能与Cl2反应生成A的烷烃是________。B中的官能团是________。
(2)反应③的化学方程式为______________________。
(3)已知:B 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。

则经反应路线②得到的一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为________。
(5)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生, 则L与NaOH的乙醇溶液共热,所得有机物的结构简式为__________________________________________________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述中,不正确的有( )
①乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 ②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 ③向蛋白质溶液中加入饱和(NH4)2SO4溶液,出现盐析现象,加水溶解 ④溴乙烷与NaOH的水溶液混合共热可得到乙烯; ⑤用盐析法分离高级脂肪酸钠和甘油的混合溶液 ⑥用渗析法除去蛋白质中混有的少量Na+和Cl-
A.①③ B.②④
C.④⑥ D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
要使蛋白质从水溶液中析出而又不改变蛋白质的主要性质,应向其中加入( )
A.大量饱和Na2SO4溶液 B.浓NaOH溶液
C.少量NaCl D.浓BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:

①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________mol·L-1。
②下列措施中能使平衡时 增大的是________(填序号)。
增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、图乙所示。下列说法不正确的是 ( )。

A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是 ( )。
A.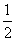 H2(g)+
H2(g)+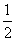 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=-91.5 kJ· mol -1
B.H2 (g) +Cl2 (g) ===2HCl (g)
ΔH=-183 kJ· mol-1
C.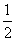 H2(g)+
H2(g)+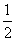 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=+91.5 kJ· mol -1
D.2HCl (g) ===H2 (g)+Cl2 (g)
ΔH=+183 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1)[2014·四川,11(4)(5)]①MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________________________________________
_______________________________________________________________。
②MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是_________________________________________________________。
(2)[(2014·江苏,20(1)]硫化氢的转化是资源利用和环境保护的重要研究课题。
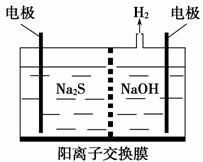
由硫化氢获得硫单质有多种方法。 将烧碱吸收H2S后的溶液加入到如上图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S
(n-1)S+S2-===S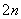
①写出电解时阴极的电极反应式:___________________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________________________________________________________。
(3)[2014·重庆,11(4)]一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
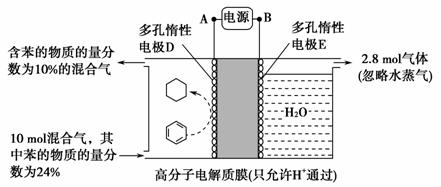
①导线中电子移动方向为________。 (用A、D表示)
②生成目标产物的电极反应式为________。
③该储氢装置的电流效率η=________(η=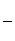 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com