
| A. | 一 | B. | 二 | C. | 三 | D. | 四 |
科目:高中化学 来源: 题型:选择题
| A. | 甲醇、乙二醇、丙三醇都易溶于水且都有剧毒 | |
| B. | 按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高 | |
| C. | 相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多 | |
| D. | 甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
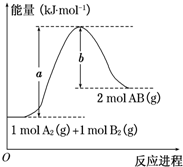 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的氢化物弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质的熔点比Z的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
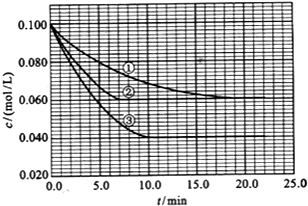 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是不活泼的金属,故铝可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,故NaHCO3可以用于制作糕点 | |
| C. | NH3能与Cl2生成NH4Cl,故可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 明矾与K2FeO4都能与水生成胶体,均可用于水的净化、杀菌和消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com