
分析 (1)对液体混合物加热时,加入沸石或碎瓷片,可防发生爆沸;
(2)、(3)乙酸乙酯的制备反应是可逆反应,为提高反应物的转化率和提高产率,通常采取增大某反应物的浓度或减小生产物的浓度的方法.
解答 解:(1)对液体混合物加热时,一定要防止溶液爆沸,所以往往要加入沸石或碎瓷片,以防发生爆沸,如果加热一段时间后发现忘记加碎瓷片,应该冷却后补加;
故答案为:碎瓷片;防止暴沸;B;
(2)乙酸乙酯的制备反应是可逆反应,反应中加入过量的乙醇,平衡向正反应方向移动,CH3COOH的转化率增大,
故答案为:提高乙酸的转化率;
(3)通过分液漏斗中边滴加乙酸边加热蒸馏,可以不断增大乙酸的浓度,减小乙酸乙酯的浓度,有利于平衡向正反应方向移动,
故答案为:及时加热蒸出乙酸乙酯,有利于酯化反应向生成酯的方向进行.
点评 本题考查有机物的合成实验方案的设计,题目难度不大,注意从平衡移动的角度分析,把握乙酸乙酯与乙酸、乙醇性质的区别.


科目:高中化学 来源: 题型:解答题
 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 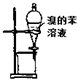 用图装置萃取溴水中的溴,并把溴的苯溶液从下口放出 | |
| B. | 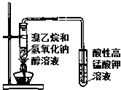 用图装置可以验证溴乙烷发生了消去反应 | |
| C. |  用图装置配制银氨溶液 | |
| D. |  用图装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | “地沟油”可用于制肥皂以及生物柴油以达到其再利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在FeCl3溶液中滴入几滴KSCN溶液,溶液变成血红色 | |
| B. | 淡黄色溴化银见光分解后变成白色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程不考虑温度变化),气体颜色逐渐变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
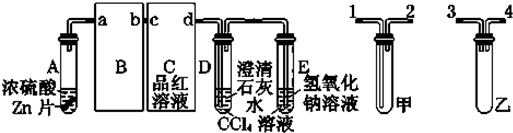
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应体系的总压恒定 | B. | A、B的浓度相等 | ||
| C. | c(A):c(B)=1:3 | D. | 2v(B)正=3v(C)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com