
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是
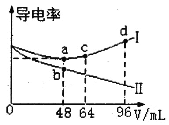
A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
【答案】C
【解析】
导电率与离子浓度成正比,向AlCl3溶液中分别加入氨水和KOH溶液,分别生成Al(OH)3和NH4Cl、Al(OH)3和KCl,当AlCl3完全反应时继续滴加碱,Al(OH)3和KOH反应生成可溶性的KAl(OH)4,一水合氨和Al(OH)3不反应,且一水合氨是弱电解质,则一水合氨溶液导电率较小,所以导电率变化较大的是氨水滴定曲线、变化较小的是KOH滴定曲线,则I为KOH滴定曲线;
A.当AlCl3和KOH恰好完全反应生成Al(OH)3和KCl时,溶液中离子浓度最小,导电率最低,则c点二者恰好完全反应,AlCl3+3KOH=Al(OH)3↓+3KCl,则n(AlCl3):n(KOH)=[c1mol·L-1×20mL]:(0.5mol·L-1×48mL)=1:3,c1=0.4,故A错误;
B.b点溶质为Al(OH)3和NH4Cl,NH4+水解导致溶液呈酸性,则c(OH-)<c(H+),故B错误;
C.ac段为Al(OH)3和KOH的反应,离子方程式为Al(OH)3+OH-═[Al(OH)4]-,故C正确;
D.d点溶液中溶质为KOH、KAl(OH)4、KCl,溶液中存在电荷守恒c(K+)+c(H+)═[Al(OH)4]-+c(OH-)+c(Cl-),故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m![]() 6
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答有关问题:
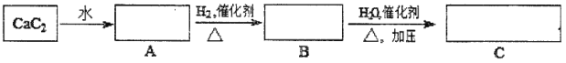
(1)A→B的反应类型是___________,实验室制取B的反应条件是________________。
(2)A和氯化氢为原料可以制得塑料聚氯乙烯。写出制备过程中最后一步发生的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
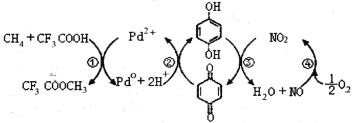
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.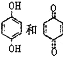 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1 h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01molL-1KMnO4溶液,几滴浓H2SO4 | 2 mL0.3molL-1 H2C2O4溶液 | 2 | 褪为无色 |
b | 4mL0.01molL-1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01molL-1K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01molL-1K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:___________。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为__________。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
实验 操作 |
|
|
|
实验 现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
实验Ⅳ的目的是:_______________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:___________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL______中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到________________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:______________
(5)综合以上实验可知,草酸发生氧化反应的速率与____________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法错误的是
A.葡萄糖和淀粉互为同系物
B.植物油含不饱和脂肪酸甘油酯,与氢气加成后生成固态的人造脂肪
C.对三联苯(![]() )分子中在同一直线上的原子最多有8个
)分子中在同一直线上的原子最多有8个
D.分子式为C7H16的烷烃,最长碳链上有5个碳原子的同分异构体共有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
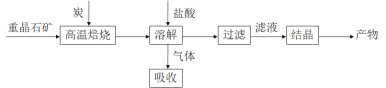
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
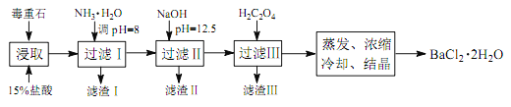
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
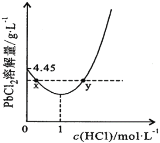
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com