
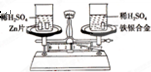
 如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )
如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )| A、65:56 | B、56:108 |
| C、56:9 | D、65:9 |
| 65 |
| x |
| 2 |
| 2 |
| 56 |
| y |
| 2 |
| 2 |


科目:高中化学 来源: 题型:
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Cl-、Mg2+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
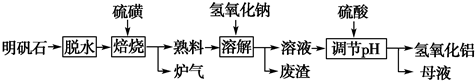
查看答案和解析>>
科目:高中化学 来源: 题型:
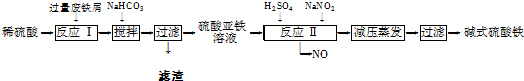
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、饱和食盐水 |
| C、饱和氯化钾溶液 |
| D、75%的酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
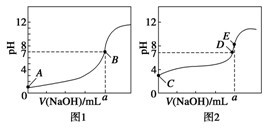
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)<c(CH3C00-) |
| B、将pH=a的醋酸稀释为pH=a+1的过程中,c(OH-)不断增大 |
| C、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
| D、浓度均为o.1 mol-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①不变浑浊②变乳白色 |
| B、①变乳白色②不变浑浊 |
| C、①变乳白色②变乳白色 |
| D、不变浑浊②变浅黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com