
将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比为
A.1∶1 B.5∶16 C.2∶3 D.3∶2
B
【解析】
试题分析:同一溶液中,离子的浓度之比等于其物质的量之比,c(Fe2+):c(Fe3+)=3:2,所以该溶液中n(Fe2+):n(Fe3+)=3:2,设亚铁离子的物质的量为3xmol,则铁离子的物质的量为2xmol,根据化学式Fe(NO3)2、Fe(NO3)3知,起酸作用的硝酸的物质的量=3xmol×2+2xmol×3=12xmol;氧化还原反应中得失电子数相等,即铁失去的电子数等于硝酸根离子得到的电子数,设作氧化剂的硝酸根离子的物质的量为ymol,所以3xmol×2+2xmol×3=3ymol,y=4x,所以参加反应的硝酸的物质的量=12xmol+4xmol=16xmol,根据铁元素守恒知,参加反应的铁的物质的量=3xmol+2xmol,所以参加反应的Fe和HNO3的物质的量之比为5xmol:16xmol=5:16,故选B。
考点:考查氧化还原反应的计算


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(18分)
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空:
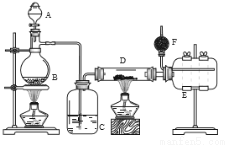
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a.吸收多余HCl b.吸收Cl2
c.吸收CO2 d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:

(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
以下物质间的转化,不能通过一步反应实现的是
A.S→SO3→H2SO4 B.Al(OH)3→Al2O3→Al
C.Cu→CuCl2→Cu(OH)2 D.Na→Na2O2→Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:实验题
(12分)某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案验证假设]该小组对燃烧后的白色产物进行如下探究:
实验 方案 | 实验操作 | 实验 现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是____________________。
(2)乙同学认为方案2得到的结论正确,白色物质为____________________。
(3)通过方案1和方案2的实验,你认为上述三个假设中,________成立。
(4)钠在二氧化碳中燃烧的化学方程式为__________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:______________、
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列关于材料的说法不正确的是
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.二氧化硅可用作光导纤维
C.石英玻璃耐强酸强碱,可用来制造化学仪器
D.Si3N4是一种新型无机非金属材料,可用于制造发动机
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥
C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3—,下列有关叙述中,正确的是:
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:
2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3 Br2+6 CO32-+3H2O=5 Br-+ BrO3-+6HCO3-
A.② ④ B.① ③ C.② ③ D.① ④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:

回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
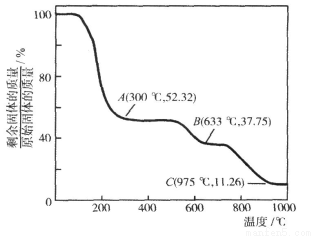
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com