
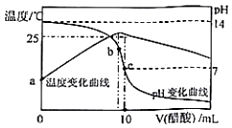
 在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | n>1.0 | B. | a点Kw=1.0×10-14 | ||
| C. | 水的电离程度:c>b | D. | b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
分析 A.酸碱中和为放热反应,二者恰好完全反应时温度最高,根据图知,温度最高时需要的醋酸体积小于10mL,此时醋酸和NaOH的物质的量相等;
B.水的电离是吸热反应,降低温度,抑制水电离,水的离子积常数变小;
C.b点溶液温度最高,则溶质为醋酸钠;c点是在b点后继续加入醋酸,溶质为醋酸钠和醋酸,酸或碱抑制水电离、含有弱离子的盐促进水电离;
D.b点溶质中溶质为醋酸钠,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒判断.
解答 解:A.酸碱中和为放热反应,二者恰好完全反应时温度最高,根据图知,温度最高时需要的醋酸体积小于10mL,此时醋酸和NaOH的物质的量相等,则n>1.0,故A正确;
B.水的电离是吸热反应,降低温度,抑制水电离,水的离子积常数变小,a点温度小于25℃,所以a点Kw<1.0×10-14,故B错误;
C.b点溶液温度最高,则溶质为醋酸钠;c点是在b点后继续加入醋酸,溶质为醋酸钠和醋酸,酸或碱抑制水电离、含有弱离子的盐促进水电离,b点促进水电离、c点抑制水电离,所以水的电离程度:c<b,故C错误;
D.b点溶质中溶质为醋酸钠,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),所以离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生分析、判断能力,明确反应过程中温度与反应的关系、溶液中溶质成分及其性质是解本题关键,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
 )是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
)是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
 结构不稳定
结构不稳定 制备氯丁橡胶的化学方程式:
制备氯丁橡胶的化学方程式: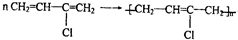 .该反应属于加聚反应(填写反应类型)
.该反应属于加聚反应(填写反应类型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖 | |
| B. | 混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法 | |
| C. | 阿司匹林具有解热镇痛作用,可预防心脏病发作,也可以作为抗酸药 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13溶液中滴加HI解液:2Fe3++2HI═2Fe2++2H++I2 | |
| B. | 1mol•L-1NaA1O2溶液和4 mol•L-1HCl溶液等体积混合:AlO2++4H+═Al3++2H2O | |
| C. | NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O | |
| D. | Na2S2O3溶液中滴加过量稀H2SO4:3S2O32-+2H+═4S↓+2SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油和鸡蛋清水解都能生成氨基酸 | |
| B. | 乙酸乙酯与乙烯在一定条件下都能与水发生加成反应 | |
| C. | 丙烯分子中最多有8个原子共平面 | |
| D. | 用碳酸钠溶液可以区分乙醇、乙酸、苯和硝基苯四种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 1:5 | C. | 6:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
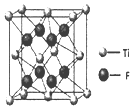 光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.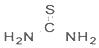 )中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.
)中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com