


 ,F
,F .
. 、
、 、
、 、
、 .
. .
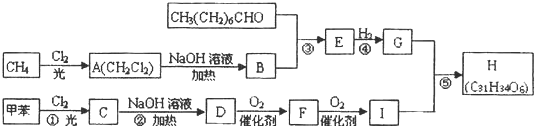
.分析 甲烷和氯气在光照条件下发生取代反应生成A(CH2Cl2),A和氢氧化钠的水溶液发生取代反应生成B,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则B的结构简式为HCHO,CH3(CH2)6CHO和甲醛反应生成E,E与氢气发生加成反应生成G,而G的分子式为C10H22O3,根据题给信息知,E的结构简式为 ,则G的结构简式为
,则G的结构简式为 .甲苯在光照条件下与氯气发生取代反应生成C,C水解得到D为醇,而醇D可以连续氧化,可知C是甲苯中甲基中1个H原子被取代,故C结构简式为
.甲苯在光照条件下与氯气发生取代反应生成C,C水解得到D为醇,而醇D可以连续氧化,可知C是甲苯中甲基中1个H原子被取代,故C结构简式为 ,顺推可知D为
,顺推可知D为 ,F为
,F为 ,I为
,I为 ,G和I反应生成H,H的结构简式为
,G和I反应生成H,H的结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:甲烷和氯气在光照条件下发生取代反应生成A(CH2Cl2),A和氢氧化钠的水溶液发生取代反应生成B,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则B的结构简式为HCHO,CH3(CH2)6CHO和甲醛反应生成E,E与氢气发生加成反应生成G,而G的分子式为C10H22O3,根据题给信息知,E的结构简式为 ,则G的结构简式为
,则G的结构简式为 .甲苯在光照条件下与氯气发生取代反应生成C,C水解得到D为醇,而醇D可以连续氧化,可知C是甲苯中甲基中1个H原子被取代,故C结构简式为
.甲苯在光照条件下与氯气发生取代反应生成C,C水解得到D为醇,而醇D可以连续氧化,可知C是甲苯中甲基中1个H原子被取代,故C结构简式为 ,顺推可知D为
,顺推可知D为 ,F为
,F为 ,I为
,I为 ,G和I反应生成H,H的结构简式为
,G和I反应生成H,H的结构简式为 ,
,
(1)反应①~⑤中.①是取代反应;②是卤代烃的水解属于取代反应;③是醛醛加成反应;④是醛基的加成反应;⑤是酯化反应,属于取代反应;属于取代反应的有①②⑤;B为HCHO,分子中的官能团为醛基;
故答案为:①②⑤;醛基;
(2)完全燃烧时,D为苯甲醇分子式为C7H8O,1molD完全燃烧耗氧量为8.5mol;
a.1molC6H6耗氧量为7.5mmol;
b.1molC7H8O3耗氧量为7.5mol;
c.1molC6H10O2耗氧量为7.5mol;
d.1molC7H8O耗氧量为8.5mmol,
故答案为:d;
(3)通过以上分析知,E: ,F为
,F为 ;
;
故答案为: ;
; ;
;
(4)I为C6H5COOH,与I互为同分异构体,且既含有苯环又能发生银镜反应的物质具有醛基,所以羧基可以变化为酯基,形成甲酸酯,也可以变化为羟基醛基,符合条件的同分异构体结构简式为: 、
、 、
、 、
、 ;
;
故答案为: 、
、 、
、 、
、 ;
;
(5)F为: ,与新制氢氧化铜悬浊液反应的化学方程式为:
,与新制氢氧化铜悬浊液反应的化学方程式为: ;
;
故答案为: ;
;
(6)A为二氯甲烷、B是甲醛,二氯甲烷和NaOH的水溶液在加热条件下发生水解反应生成甲醛,反应方程式为CH2Cl2+2NaOH$\stackrel{△}{→}$HCHO+2NaCl+H2O,
故答案为:CH2Cl2+2NaOH$\stackrel{△}{→}$HCHO+2NaCl+H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及获取信息利用信息解答问题能力,根据某些物质分子式、反应条件再结合题给信息进行推断,正确判断各物质结构简式是解本题关键,注意题给信息中断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有分子的数目为0.5NA | |
| B. | 电解精炼铜的过程中转移了NA个电子,则阴极析出32 g铜 | |
| C. | 2.8 g由氮气和一氧化碳组成的混合气体中含有原子的数目为0.1NA | |
| D. | 加热条件下,20mL 10 mol/L 浓硝酸与足量铜反应转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用手扇动收集的气体,有气味则已收集满 | |
| B. | 将润湿的淀粉-KI试纸接近瓶口,试纸变蓝则已收集满 | |
| C. | 将润湿的红色石蕊试纸伸入瓶内,试纸腿色则已收集满 | |
| D. | 将铁丝伸到瓶口,铁丝燃烧说明已收集满 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| B. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com