
| HCN | S8 | SF6分子 | B12结构单元 | |
| 结构模型示意图 |  |  |  |  |
| 备注 | / | 易溶于CS2 | / | 熔点1873K |
| A、HCN的结构式为H-C≡N |
| B、固态硫S8属于原子晶体 |
| C、SF6是由极性键构成的非极性分子 |
| D、单质硼属原子晶体,结构单元中含有30个B-B键 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
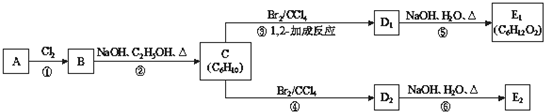
 反应的化学方程式:
反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
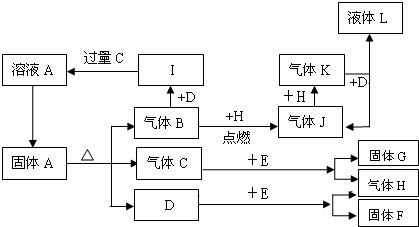
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-CH=CH-CHO |
| B、HOCH2-CH2-CH=CH-CHO |
| C、CH3 CH(OH)CH(OH)CH3 |
| D、HOCH2COCH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com